
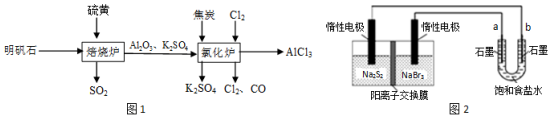
分析 (1)亞硫酸放置在空氣中被氧化為硫酸,硫酸為強酸,酸性增大;
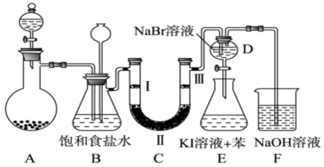
(2)焦炭能與氧氣反應,使生成物氧氣的濃度減小,且焦炭與氧氣的反應為放熱反應,溫度升高,均有利于反應的正向移動;
(3)①用惰性電極電解飽和食鹽水,由氯離子和水中的氫離子放電得到氯氣和氫氣;
②原電池左側發生氧化反應,為負極,右側為正極,電解質溶液陽離子向正極移動;由反應2Na2S2+NaBr3$\frac{\underline{\;放電\;}}{\;}$Na2S4+3NaBr可知,左側S22-放電生成S42-.
解答 解:(1)酸雨中的弱酸亞硫酸被氧化為強酸硫酸,2H2SO3+O2=2H2SO4,使溶液中的c(H+)增大,pH減小;
故答案為:酸雨中的弱酸亞硫酸被氧化為強酸硫酸,2H2SO3+O2=2H2SO4,使溶液中的c(H+)增大,pH減小;
(2)焦炭可消耗產物中的氧氣,使c(O2)變小;且放出熱量,2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)為吸熱反應,溫度升高,導致平衡向正反應方向移動;
故答案為:焦炭可消耗產物中的氧氣,使c(O2)變小;且放出熱量,溫度升高,導致平衡向正反應方向移動;
(3)①用惰性電極電解飽和食鹽水,氯離子放電生成氯氣,水中的氫離子放電生成氫氣,則離子方程式為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑;
②原電池左側發生氧化反應,為負極,右側為正極,電解質溶液陽離子向正極移動;由反應2Na2S2+NaBr3$\frac{\underline{\;放電\;}}{\;}$Na2S4+3NaBr可知,左側S22-放電生成S42-;
故答案為:右槽;2S22-?2e-=S42-.
點評 本題考查化學平衡移動、元素化合物性質、原電池、電解池、實驗方案設計等,是對學生綜合能力的考查,需要學生具備扎實的基礎與靈活運用能力,題目難度中等.


 全能測控一本好卷系列答案
全能測控一本好卷系列答案科目:高中化學 來源: 題型:選擇題
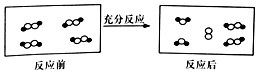 一定條件下,某容器中各微粒在反應前后變化的示意圖如圖,其中•和○代表不同元素的原子.關于此反應說法正確的是( )
一定條件下,某容器中各微粒在反應前后變化的示意圖如圖,其中•和○代表不同元素的原子.關于此反應說法正確的是( )| A. | 屬于化合反應 | B. | 屬于置換反應 | ||
| C. | 屬于氧化還原反應 | D. | 屬于復分解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用催化設施,可以將汽車尾氣中CO和NO轉化為無害氣體 | |
| B. | 半導體行業中有一句話:“從沙灘到用戶”,計算機芯片的材料是二氧化硅 | |
| C. | 鍋爐水垢中含有的CaSO4,可先用Na2CO3溶液處理,后用酸除去 | |
| D. | 防止酸雨發生的重要措施之一是使用清潔能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
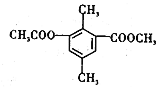
| A. | 分子中不同化學環境的氫共有4種 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol該有機物與足量NaOH溶液反應,最多消耗3mol NaOH | |
| D. | 能發生取代、消去、加成和氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
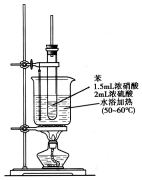 純硝基苯是一種具有苦杏仁氣味的無色油狀液體,密度比水大,是制造染料的重要原料,實驗室用如圖所示的裝置來制取.
純硝基苯是一種具有苦杏仁氣味的無色油狀液體,密度比水大,是制造染料的重要原料,實驗室用如圖所示的裝置來制取.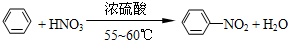 .
. ),導致硝基苯的產率下降.寫出發生副反應的化學方程式
),導致硝基苯的產率下降.寫出發生副反應的化學方程式 +H2SO4(濃)$\stackrel{△}{→}$
+H2SO4(濃)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
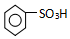
| a | b | c | d | |
| Ⅰ | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液、萃取、蒸餾 | B. | 分液、蒸餾、萃取 | C. | 蒸餾、萃取、分液 | D. | 萃取、蒸餾、分液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com