
【題目】一種用鋁土礦和硫鐵礦燒渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)為原料制備無機高分子絮凝劑聚合堿式氯化鋁鐵的流程如下:

(1)配料中屬于兩性氧化物的是______,步驟Ⅱ酸溶時,Fe2O3被溶解的化學方程式為_____。
(2)“濾渣1”的主要成分為________ (填化學式),為檢驗“過濾1”后的溶液中是否含有Fe3+,可選用的化學試劑是_________。
(3)步驟Ⅳ加入H2O2溶液的目的是______,發生反應的離子方程式為__。
(4)步驟Ⅴ調節pH=3發生反應生成聚合堿式氯化鋁鐵,若溶液pH過大,可能造成的影響是_________;步驟Ⅵ包含的操作有過濾、________、干燥得到產品。
(5)測定聚合堿式氯化鋁鐵{可表示為[FeaAlb(OH)xCly]n}中n(Fe)/n(Al)的比值的步驟如下:
步驟1:準確稱取產品5.710g溶于水,加入足量的稀氨水,過濾,將濾渣灼燒至質量不再變化,得到3.350g固體。
步驟2:另準確稱取相同質量樣品,溶于足量NaOH溶液,過濾,充分洗滌,將濾渣灼燒至質量不再變化,得到固體0.8000g。
計算產品中n(Fe)/n(Al)的比值。(寫出計算過程)____________
【答案】Al2O3 Fe2O3+ 6HCl=2FeCl3+3H2O SiO2 KSCN溶液 把溶液中的亞鐵離子氧化為鐵離子 2Fe2++ H2O2+2H+= 2Fe3++2H2O 得到的是Fe(OH)3和Al(OH)3 洗滌 5:1
【解析】
由流程圖可知,鋁土礦和硫鐵礦燒渣酸溶時,Al2O3、Fe2O3和FeO與鹽酸反應生成氯化鋁、氯化鐵和氯化亞鐵,SiO2不與鹽酸反應,過濾得含有氯化鋁、氯化鐵和氯化亞鐵的濾液,濾渣1為沒有反應的SiO2;酸性條件下,向濾液中加入雙氧水溶液,氯化亞鐵被雙氧水氧化生成氯化鐵;向反應后的溶液中加入氫氧化鈉溶液,調節溶液pH為3,促進氯化鋁和氯化鐵的水解得到聚合堿式氯化鋁鐵,若溶液pH過大,可能會使氯化鋁和氯化鐵轉化為Fe(OH)3和Al(OH)3沉淀,降低聚合堿式氯化鋁鐵的產率;靜置后,過濾、洗滌和干燥得到聚合堿式氯化鋁鐵產品。
(1)配料中Al2O3為兩性氧化物,Fe2O3、FeO為堿性氧化物,SiO2為酸性氧化物;步驟Ⅱ酸溶時,Fe2O3與鹽酸反應生成氯化鐵和水,反應的化學方程式為Fe2O3+6HCl=2FeCl3+3H2O,故答案為:Al2O3;Fe2O3+ 6HCl=2FeCl3+3H2O;
(2)酸性氧化物SiO2不與鹽酸反應,過濾得到的濾渣1為沒有反應的SiO2;實驗室用KSCN溶液檢驗Fe3+,故答案為:SiO2;KSCN溶液;
(3)步驟Ⅳ為酸性條件下,氯化亞鐵被雙氧水氧化生成氯化鐵,反應的離子方程式為2Fe2++ H2O2+2H+=2Fe3++2H2O,故答案為:2Fe2++ H2O2+2H+=2Fe3++2H2O;
(4)步驟V若將溶液pH過大,可能會使氯化鋁和氯化鐵轉化為Fe(OH)3和Al(OH)3沉淀,降低聚合堿式氯化鋁鐵的產率;靜置后,過濾、洗滌和干燥得到聚合堿式氯化鋁鐵產品,故答案為:得到的是Fe(OH)3和Al(OH)3;洗滌;
(5)由步驟2在5.710樣品中:160g·mol-1×n(Fe2O3)=0.8000g,n(Fe2O3)=0.0050mol,相,由步驟1在5.710g樣品中:102g·mol-1×n(Al2O3)+160g·mol-1×n(Fe2O3)=3.350g,102g·mol-1×n(Al2O3)=3.350g-0.8000g,n(Al2O3)=0.025mol,則n(Al):n(Fe)=(2×0.025mol):(2×0.005mol)=5:1,即產品中n(Fe)/n(Al)的比值為:5:1。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列有關敘述正確的是( )
A. 乙烯和丙烯組成的42g混合氣體中碳氫鍵數目為6NA
B. 標準狀兄下,22.4L二氯甲烷的分子數約為NA
C. 常溫常壓下,1mol甲醇完全燃燒生成CO2和H2O,轉移的電子數目為12NA
D. 將1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-數目小于NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
B. 煤的氣化就是把煤轉化為可燃性氣體的過程,該氣體可用來合成液態烴及甲醇等含氧有機物
C. 等物質的量的乙烯和乙醇完全燃燒,乙烯消耗的氧氣多
D. 間二甲苯只有一種結構,說明苯不是單雙鍵交替的結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作環保型阻燃材料,受熱時按如下化學方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)寫出該化合物作阻燃劑的兩條依據____________。
(2)用離子方程式表示除去固體產物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化學方程式表示其原理____________。
Ⅱ.磁性材料A是由兩種元素組成的化合物,某研究小組按如圖流程探究其組成:

請回答:
(1)A的組成元素為_________(用元素符號表示),化學式為______。
(2)溶液C可溶解銅片,例舉該反應的一個實際應用____________。
(3)已知化合物A能與稀硫酸反應,生成一種淡黃色不溶物和一種氣體(標況下的密度為1.518 g·L-1),該氣體分子的電子式為____。寫出該反應的離子方程式__________。
(4)寫出F→G反應的化學方程式_____________。設計實驗方案探究溶液G中的主要微粒(不考慮H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下鐵可以和CO2發生反應Fe(s)+CO2(g)![]() FeO(s)+CO(g) 一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,反應過程中CO2氣體和CO氣體的濃度與時間的關系如圖所示。
FeO(s)+CO(g) 一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,反應過程中CO2氣體和CO氣體的濃度與時間的關系如圖所示。

(1)t1時,正、逆反應速率的大小關系為ν正______ν逆(填“>”“<”或“=”);
(2)4分鐘內,CO2的轉化率為__________;CO的平均反應速率v(CO)=__________________;
(3)下列條件的改變能減慢其反應速率的是______________(選填序號)
①降低溫度 ②減少鐵粉的質量 ③保持壓強不變,充入He使容器的體積增大 ④保持體積不變,充入He使體系壓強增大
(4)下列描述能說明上述反應已達平衡的是__________________(選填序號)
①v(CO2)=v(CO)
②單位時間內生成n molCO2的同時生成n mol CO
③ 容器中氣體壓強不隨時間而變化
④容器中氣體的平均分子量不隨時間而變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】萜類化合物廣泛存在于動植物體內。下列關于萜類化合物a、b的說法錯誤的是
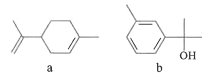
A. a與![]() 互為同分異構體
互為同分異構體
B. b中所有的碳原子不可能處于同一平面
C. b生成1mol 至少需要3molH2
至少需要3molH2
D. a中六元環上的一氯代物共有5種(不考慮立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組設計的用化學電源使LED燈發光,裝置如下。下列說法錯誤的是

A.銅片表面有氣泡生成B.裝置中存在“化學能→電能→光能”的轉換
C.電子由鋅片→稀硫酸→銅片D.電解質溶液中,陽離子移向銅片
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下述實驗方案能達到實驗目的的是( )
編號 | A | B | C | D |
實驗方案 |
|
|
|
|
實驗目的 | 實驗室制備乙酸乙酯 | 分離乙酸和水 | 驗證溴乙烷在氫氧化鈉乙醇溶液中發生消去反應產生的乙烯 | 收集乙烯并驗證它與溴水發生加成反應 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產上用過量燒堿溶液處理某礦物(含Al2O3、MgO),過濾后得到的濾液用 NaHCO3溶液處理,測得溶液的pH和Al(OH)3生成的量隨加入NaHCO3溶液體積變化的曲線如下圖所示。下列有關說法錯誤的是
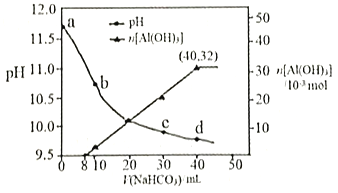
A. a點溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的電離程度:a點小于c點
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的離子方程式為HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com