
【題目】Ⅰ.控制變量法是化學實驗的一種常用方法。下表是某學習小組研究等物質的量濃度的稀硫酸和鋅反應的實驗數據,分析以下數據,回答下列問題:
序號 | 硫酸的體積/mL | 鋅的質量/g | 鋅的形狀 | 溫度/℃ | 完全溶于酸的時間/s | 生成硫酸鋅的質量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 顆粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 顆粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化學反應速率本質上是由物質的性質決定的,但外界條件也會影響反應速率的大小。本實驗中實驗2和實驗3對比得出的結論是______________________________。
(2)我們最好選取實驗________(填3個實驗序號)研究鋅的形狀對反應速率的影響。
(3)若采用與實驗1完全相同的條件,但向反應容器中滴加少量硫酸銅溶液,發現反應速率明顯加快。原因是______________________________。
(4)利用表中數據,可以求得:硫酸的物質的量濃度是________mol/L。
Ⅱ.某溫度時,在5 L的容器中,X、Y、Z三種氣體的物質的量隨時間的變化曲線如圖所示。請通過計算回答下列問題:
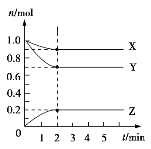
(5)反應開始至2 min,Y的平均反應速率______________________。
(6)分析有關數據,寫出X、Y、Z的反應方程式_________________。
【答案】其他條件相同時,溫度越高化學反應速率越大 1、2和4 鋅會置換出少量的金屬銅,在該條件下構成了原電池,加快了反應速率 2.0 0.03 mol/(L·min) X(g)+3Y(g)2Z(g)
【解析】
Ⅰ.(1)根據決定化學反應速率的本質因素進行解答;根據實驗2和實驗3的反應條件進行分析;溫度越高,反應速率會越快;
(2)研究鋅的形狀對反應速率的影響時,除了鋅的規格不同外,其它條件必須完全相同;反應物的接觸面積越大,反應速率越快;
(3)根據加入少量硫酸銅,可以構成原電池,即可加快反應速率進行解答;
(4)根據加入8g鋅和加入10g鋅生成的硫酸鋅質量相同可知,該兩種條件下硫酸完全反應,據此計算出硫酸鋅的物質的量及硫酸的物質的量濃度;
Ⅱ.(5)據反應速率v=![]() 計算該反應的反應速率;
計算該反應的反應速率;
(6)根據物質的量的變化判斷反應物和生成物,根據物質的量的變化之比等于化學計量數之比書寫方程式。
Ⅰ.(1)化學反應速率本質上是由反應物本身的性質決定的;實驗2和實驗3中,除了溫度不同外,其它條件完全相同,則說明探究的是溫度對反應速率的影響;即本實驗中實驗2和實驗3對比得出的結論為其他條件相同時,溫度越高化學反應速率越大;
(2)根據表中數據可知,實驗1、2和4中,除了鋅的形狀不同外,其它條件完全相同,則它們是探究鋅的形狀對反應速率的影響;
(3)若采用與實驗1完全相同的條件,但向反應容器中滴加少量硫酸銅溶液,由于鋅會置換出少量的金屬銅,在該條件下構成了原電池,所以反應速率明顯加快;
(4)根據實驗6和實驗7可知,加入8g鋅后與加入10g鋅生成的硫酸鋅質量相同,說明兩個實驗中硫酸完全反應,16.1g硫酸鋅的物質的量為:![]() =0.1mol,則原硫酸溶液的物質的量濃度為:
=0.1mol,則原硫酸溶液的物質的量濃度為:![]() =2.0mol/L;
=2.0mol/L;
Ⅱ.(5)反應開始至2min時,Y的物質的量減少了1.0mol-0.7mol=0.3mol,所以反應速率為: =0.03 mol/(Lmin);
=0.03 mol/(Lmin);
(6)根據圖象可知X、Y的物質的量減小,Z的物質的量增加,則X和Y是反應物,Z是生成物,且分別是0.1mol、0.3mol、0.2mol,由于變化量之比是相應的化學計量數之比,所以其系數之比為:0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式為:X(g)+3Y(g)2Z(g)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】無色透明的酸性溶液中,可能大量含有的離子組是
A.Na+、NH4+、NO3-、SiO32-B.Na+、Cu2+、SO42-、Cl-
C.Mg2+、Al3+、Cl-、NO3-D.K+、Ag+、HCO3-、Br-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2 L容器中3種物質間進行反應,X、Y、Z的物質的量隨時間的變化曲線如圖。反應在t1 min時到達平衡,如圖所示:
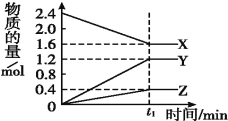
(1)①該反應的化學方程式是_______________________________。
②在t1 min時,該反應達到了____狀態,下列可作為判斷反應已達到該狀態的是____。
A.X、Y、Z的反應速率相等 B.X、Y的反應速率比為2∶3
C.生成3 mol Y的同時生成1 mol Z D.生成1 mol Z的同時生成2 mol X
(2)①若上述反應中X、Y、Z分別為NH3、H2、N2,且已知1 mol 氨氣分解成氮氣和氫氣要吸收46 kJ的熱量,則至t1 min時,該反應吸收的熱量為____:在此t1 min時間內,用H2表示反應的平均速率v(H2)為_________。
②兩位同學討論放熱反應和吸熱反應。甲說加熱后才能發生的化學反應是吸熱反應,乙說反應中要持續加熱才能進行的反應是吸熱反應。你認為說法中正確的是____同學。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KMnO4在生產和生活中有著廣泛的用途。某化學小組在實驗室制備KMnO4并探究其性質。請回答下列問題:
(一)KMnO4的制備。
步驟I 先利用如圖甲所示裝置由MnO2制備KMnO4。
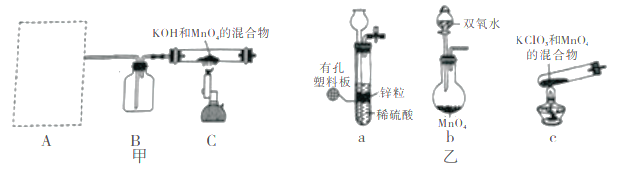
(1)裝置A應選用圖乙中的_______(填“a”“b”或“c”)。
(2)裝置B中所盛試劑的名稱為________。
(3)裝置C處制備K2MnO4的化學方程式為________。
步驟II 由K2MnO4制備KMnO4。已知:K2MnO4易溶于水,水溶液呈墨綠色。主要過程如下:
①充分反應后,將裝置C處所得固體加水溶解,過濾;
②向①的濾液中通入足量CO2,過濾出生成的MnO2;
③將②的濾液經過蒸發濃縮、降溫結晶、過濾、洗滌、干燥等一系列實驗操作,得KMnO4晶體。
(4)過程②向①的濾液中通人足量CO2,其還原產物為_______。
(5)過程③干燥KMnO4時,溫度不宜過高的原因是__________。
(二)KMnO4的性質。
KMnO4具有強氧化性。某化學學習小組利用其性質測定H2C2O4溶液的濃度。
反應:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(6)①滴定終點現象是:當加入最后一滴酸性KMnO4溶液時,溶液顏色______,且半分鐘內不褪色。
②c(標準KMnO4溶液)=0.20mol/L,滴定時所得的實驗數據如下表,試計算所測H2C2O4溶液的濃度為_______mol/L。
實驗次數編號 | 待測液體積(mL) | 滴入的標準液體積(mL) |
1 | 10.00 | 22.95 |
2 | 10.00 | 20.05 |
3 | 10.00 | 19.95 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池是化學對人類的一項重大貢獻。
(1)某興趣小組為研究電池原理,設計如圖A裝置。
|
|
A | B |
①a和b不連接時,燒杯中發生反應的離子方程式是___________________。
②a和b用導線連接,Cu極為原電池________(填“正”或“負”)極,該電極反應式是____________________________。
③無論a和b是否連接,Zn片均被腐蝕,若轉移了0.4 mol電子,則理論上Zn片質量減輕________ g。
(2)如圖B是甲烷燃料電池原理示意圖,回答下列問題:
①電池的負極是________(填“a”或“b”)電極,該極的電極反應式為________________。
②電池工作一段時間后電解質溶液的pH________(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能大量存在:H+、Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的幾種離子,現進行了如下實驗:
① 取該溶液10.0mL,加入過量Ba(NO3)2溶液,產生白色沉淀x和無色氣體a,a遇空氣立即變為紅棕色氣體b;過濾。
② 向①所得的濾液中加入過量NaOH溶液,產生紅褐色沉淀y,過濾,加熱濾液有無色刺激性氣體c生成;用鉑絲蘸取濾液,在火焰上灼燒,火焰呈黃色。
③ 向②所得的濾液中通入過量CO2氣體有白色沉淀z生成。
下列推斷錯誤的是
A. 原溶液一定只含有:Na+、Fe2+、Al3+、SO42-
B. 實驗① 的紅棕色氣體b中存在:2NO2![]() N2O4。
N2O4。
C. 實驗② 中產生沉淀y的反應:Fe3++3OH-=Fe(OH)3↓
D. 實驗③ 中CO2先后分別與NaOH(aq)、NaAlO2(aq)反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸鈷可用于指示劑和催化劑的制備。用水鈷礦(主要成分為Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工藝流程如下:
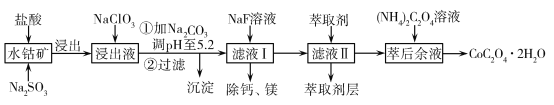
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性條件下,ClO不會氧化Co2+,ClO轉化為Cl-;③部分陽離子以氫氧化物形式沉淀時溶液的pH見表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出過程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的離子反應方程式:________。
(3)已知:常溫下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
則該流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶體,再過濾、洗滌,洗滌時可選用的試劑有:________。
A.蒸餾水 B.自來水
C.飽和的(NH4)2C2O4溶液 D.稀鹽酸
(5)萃取劑對金屬離子的萃取率與pH的關系如圖,萃取劑的作用是________;其使用的適宜pH范圍是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
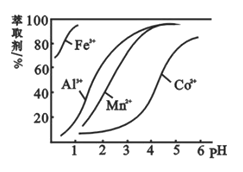
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,金屬硫化物的沉淀溶解平衡曲線如圖所示。縱坐標p(Mn+)表示-lgc(Mn+),橫坐標p(S2-)表示-lgc(S2-),下列說法不正確的是( )
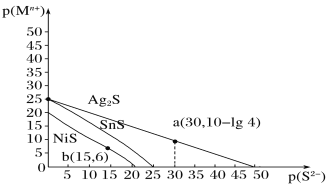
A. 該溫度下,Ag2S的Ksp=1.6×10-49
B. 該溫度下,溶解度的大小順序為NiS>SnS
C. SnS和NiS的飽和溶液中![]() =104
=104
D. 向含有等物質的量濃度的Ag+、Ni2+、Sn2+溶液中加入飽和Na2S溶液,析出沉淀的先后順序為Ag2S、SnS、NiS
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com