
【題目】某實驗興趣小組按下圖裝置實驗后,所記錄內容合理的是( )
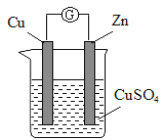
實驗 記錄 | ① Cu為正極,Zn為負極; ② Zn質量減少,Cu質量增加; ③ SO ④ 電子流方向是:由Zn經導線流入Cu片; ⑤ Zn電極發生還原反應; ⑥ 正極反應式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如圖所示。甲與戊的原子序數相差3,戊是空氣中含量最多的元素,丁與辛是同周期元素。下列說法正確的是( )
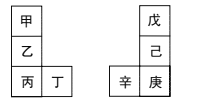
A.丙不能與水發生反應
B.己和氯氣反應的產物只有一種
C.丙與庚的原子核外電子數相差13
D.乙形成的氧化膜疏松,不能保護內層金屬
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知冰晶石(Na3AlF6)熔融時的電離方程式為Na3AlF6=3Na++AlF63-。現有冰晶石的結構單元如圖所示,![]() 位于大立方體頂點和面心,
位于大立方體頂點和面心,![]() 位于大立方體的12條棱的中點和8個小立方體的體心,▽是圖中
位于大立方體的12條棱的中點和8個小立方體的體心,▽是圖中![]() 、
、![]() 中的一種。下列說法正確的是( )
中的一種。下列說法正確的是( )
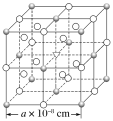
A.冰晶石是原子晶體
B.大立方體的體心處▽代表Al3+
C.與Na+距離相等且最近的Na+有6個
D.冰晶石晶體的密度為![]() ×1024g·cm-3
×1024g·cm-3
查看答案和解析>>
科目:高中化學 來源: 題型:
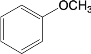
【題目】去甲腎上腺素是一種重要的神經遞質,以石油裂解產物A和鄰甲氧基苯酚為原料,經過中間體藜蘆醛,合成去甲腎上腺素的路線如下所示。
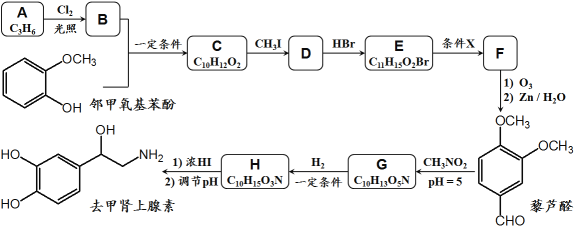
已知:①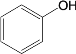
![]()
![]()

②![]()
![]()
![]() +
+![]()
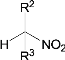
③![]() +
+
![]()
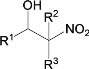
④D和F互為同分異構體。
回答下列問題:
(1)C → D的反應類型為__________,G → H的反應類型為__________;
(2)條件X為__________,E在條件X作用下發生變化的官能團名稱為__________;
(3)關于上述合成,下列說法正確的是__________;(填序號)
a.1mol鄰甲氧基苯酚能與3mol Br2發生取代反應
b.合成路線中CH3I和濃HI的作用是保護酚羥基不被O3氧化
c.藜蘆醛分子中至少有14個原子共平面
d.1mol去甲腎上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 鄰甲氧基苯酚 → C的化學方程式為_______________________________;
(5)藜蘆醛的同系物Y相對分子質量比藜蘆醛大14,寫出Y滿足下列條件所有同分異構體的結構簡式:
①能發生銀鏡反應;②1mol該有機物能消耗2mol NaOH(aq);③核磁共振氫譜有4組峰
__________________________________________________________;
(6)試設計以間苯二酚(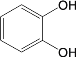 )為原料,制備聚酯
)為原料,制備聚酯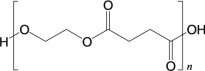 的合成路線。(無機試劑任選,僅可使用間苯二酚作有機原料)___________
的合成路線。(無機試劑任選,僅可使用間苯二酚作有機原料)___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:![]() ,
,![]() 。
。![]() 時,向
時,向![]() 溶液中滴加氫氧化鈉溶液,混合溶液的pOH與
溶液中滴加氫氧化鈉溶液,混合溶液的pOH與![]() 的變化關系如圖所示。下列敘述正確的是
的變化關系如圖所示。下列敘述正確的是

A.M點溶液中:![]()
B.![]() 的數量級為
的數量級為![]()
C.M點到N點: 的值不變
的值不變
D.N點:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】捕獲二氧化碳生成甲酸的過程如圖所示。下列說法不正確的是(NA為阿伏加德羅常數的值)
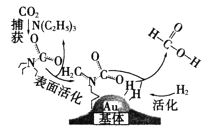
A.10.1gN(C2H5)3中所含的共價鍵數目為2.1NA
B.標準狀況下,22.4LCO2中所含的電子數目為16NA
C.在捕獲過程中,二氧化碳分子中的共價鍵完全斷裂
D.100g 46%的甲酸水溶液中所含的氧原子數目為5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦主要成分為Cu2S,軟錳礦主要成分為MnO2,它們都含有少量SiO2、Fe2O3等雜質。工業上綜合利用這兩種礦物制備硫酸錳和堿式碳酸銅的主要工藝流程如下:
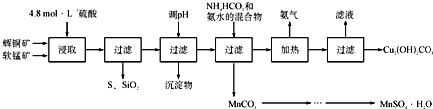
已知:①MnO2能將金屬硫化物中的硫氧化為單質硫;
②[Cu(NH3)4]SO4常溫穩定,在熱水中會分解生成NH3;
③部分金屬陽離子生成氫氧化物沉淀的pH范圍如下表所示(開始沉淀的pH按金屬離子濃度為1.0molL-1計算):
開始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸時,為了提高浸取率可采取的措施有____________________(任寫一點);
(2)調節浸出液pH的范圍為____________,其目的是_______________________;
(3)本工藝中可循環使用的物質是____________________(寫化學式).
(4)在該工藝的“加熱驅氨”環節,若加熱的溫度較低或過高,都將造成_________________的結果;
(5)碳酸錳在一定條件下可得硫酸錳溶液,試根據如下曲線圖示,現由硫酸錳溶液制備MnSO4·H2O的實驗方案為____________________。
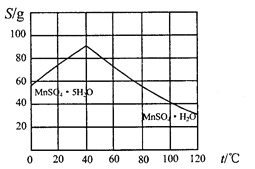
(6)用標準BaCl2溶液測定樣品中MnSO4H2O質量分數時,發現樣品純度大于100%(測定過程中產生的誤差可忽略),其可能原因有_________________(任寫一種)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用生活中或實驗室中的常用物品,根據氧化還原反應知識和電化學知識,自己動手設計一個原電池.請填寫下列空白:
(1)實驗原理:Fe+2H+=Fe2++H2↑
(2)實驗用品:電極(__、__)、稀硫酸、__、__耳機(或電流計).
(3)①按如圖所示裝置連接好實驗儀器,這時可以聽見耳機發出“嚓嚓……”的聲音。其原因是在原電池中化學能轉化為__,在耳機中__又轉化為聲波這種能量。
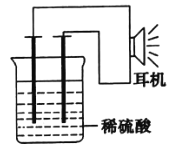
②在該原電池內中,Fe在___極發生了___反應,H+在___極發生了___反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組擬用pH試紙驗證醋酸是弱酸。甲、乙兩同學的方案分別是
甲:①準確配制0.1mol·L-1的醋酸鈉溶液100mL;
②用pH試紙測出該溶液的pH,即可證明醋酸是弱酸。
乙:①量取一定量的冰醋酸準確配制pH=1的醋酸溶液100mL;
②取醋酸溶液1mL,加水稀釋為10 mL;
③用pH試紙測出②中溶液的pH,即可證明醋酸是弱酸。
(1)兩個方案的第①步中,都要用到的定量儀器是______________________,簡要說明pH試紙的使用方法:______________________________。
(2)甲方案中,說明醋酸是弱酸的理由是測得醋酸鈉溶液的pH________(選填“<”“>”或“=”,下同)7,乙方案中,說明醋酸是弱酸的理由是測得醋酸溶液的pH________2。
(3)請你評價乙方案的不妥之處:_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com