(1)甲醇是一種可再生能源,工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H
2(g)

CH
3OH(g)
反應Ⅱ:CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)
反應Ⅲ:甲醇燃燒2CH
3OH(g)+3O
2(g)═2CO
2(g)+4H
2O(g)
上述反應符合“原子經濟”原則的是
Ⅰ
Ⅰ
(填“Ⅰ”或“Ⅱ”).
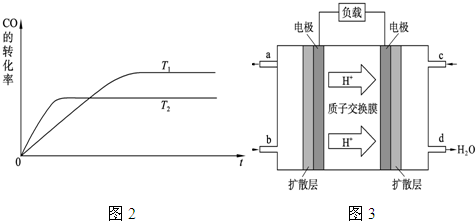
(2)依據甲醇燃燒的反應原理,設計如圖所示的電池裝置.
①該電池正極的電極反應為
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.
②工作一段時間后,測驗得溶液的pH減小,該電池總反應的
化學方式式為
2CH3OH+3O2+4OH-=2CO32-+6H2O
2CH3OH+3O2+4OH-=2CO32-+6H2O
.
(3)甲烷也是一種可再生的能源,如果用甲烷來制水煤氣,反應方程式為:
CH
4(g)+H
2O(g)

CO(g)+3H
2(g)
△H═+206kJ/mol
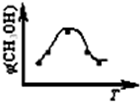
在一體積恒定為1L的密閉器中用1mol甲烷和1mol水蒸氣進行以上反應,測得甲烷的物質的量濃度隨反應時間的變化如圖所示.
①反應在0~5min這段時間共吸收的熱量為
103
103
kJ;
②進行到5min時,反應達到平衡,這時平衡常數K的數值為
6.75
6.75
;
③進行到8min時,只改變了影響平衡的一個條件:水蒸氣的濃度.10min達到新的平衡,這時c(H
2O)=
5.1
5.1
mol/L.(小數點后面保留一位數)


 CH3OH(g)
CH3OH(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
 CO(g)+3H2(g),△H═+206kJ/mol的含義,所以消耗的甲烷的濃度為0.5mol/L時,吸收的熱量為:
CO(g)+3H2(g),△H═+206kJ/mol的含義,所以消耗的甲烷的濃度為0.5mol/L時,吸收的熱量為: CO(g)+3H2(g)
CO(g)+3H2(g)

 (2012?丹東模擬)能源短缺是人類面臨的重大問題.甲醇是一種可再生能源.具有廣泛的開發和應用前景.因此甲醇被稱為21世紀的新型燃料.
(2012?丹東模擬)能源短缺是人類面臨的重大問題.甲醇是一種可再生能源.具有廣泛的開發和應用前景.因此甲醇被稱為21世紀的新型燃料.
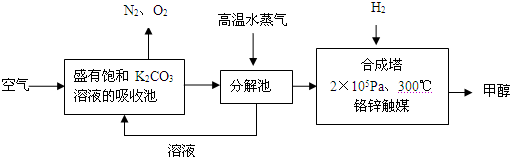
 能源短缺是人類面臨的重大問題.甲醇是一種可再生能源,具有廣泛的開發和應用前景.
能源短缺是人類面臨的重大問題.甲醇是一種可再生能源,具有廣泛的開發和應用前景.