
【題目】一定條件下存在反應:2SO2(g)+O2(g)![]() 2SO3(g),其正反應放熱。現有三個體積相同的密閉容器Ⅰ、Ⅱ、Ⅲ,按如下圖所示投料,并在400℃條件下開始反應。達到平衡時,下列說法正確的是( )
2SO3(g),其正反應放熱。現有三個體積相同的密閉容器Ⅰ、Ⅱ、Ⅲ,按如下圖所示投料,并在400℃條件下開始反應。達到平衡時,下列說法正確的是( )

A. 容器I、Ⅲ中平衡常數相同
B. 容器II、Ⅲ中正反應速率相同
C. 容器Ⅱ、Ⅲ中的反應達平衡時,SO3的體積分數:II 〈 III
D. 容器Ⅰ中SO2的轉化率與容器Ⅱ中SO3的轉化率之和小于1
【答案】D
【解析】
若在恒溫恒容條件下,三個容器中的反應為等效平衡。
A、容器Ⅰ是絕熱容器,反應過程中溫度升高,平衡逆向進行;
B、容器Ⅱ是恒溫恒容,Ⅲ是恒壓容器,反應過程中隨著SO2轉化為SO3,容器Ⅱ的壓強會增大,反應速率會比容器Ⅲ大;
C、容器Ⅱ是恒溫恒容,Ⅲ是恒溫恒壓,隨著反應的進行,容器Ⅱ中壓強大于容器Ⅲ,平衡正向進行,三氧化硫含量增大,Ⅱ>Ⅲ;
D、若容器Ⅱ恒溫恒容,容器Ⅰ是恒溫恒容時,達到相同平衡狀態,二氧化硫轉化率和三氧化硫轉化率之和為1,實際容器Ⅰ是絕熱恒容,隨著反應的進行,溫度升高,平衡逆向進行,二氧化硫轉化率減小。
A項、絕熱條件下溫度發生變化,平衡常數變化,A錯誤;
B項、Ⅲ壓強不變,Ⅱ壓強增大,反應速率不同,B錯誤;
C項、容器Ⅱ壓強大,平衡逆向移動,轉化率小,SO3的體積分數大,C錯誤;
D項、若為恒溫條件,則兩容器中建立等效平衡,容器I中SO2的轉化率與容器Ⅱ中SO3的轉化率之和等于1,但反應放熱容器Ⅰ溫度升高,平衡逆向移動,故兩容器轉化率之和小于1,D正確。
故選D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.含碳元素的化合物都是有機物
B.有機物都難溶于水
C.有機化合物與無機化合物的性質完全不同
D.大多數有機物受熱易分解,但有的具有較強熱穩定性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示A是固體金屬單質,燃燒時火焰呈黃色。

(1)寫出下列轉化的化學方程式。
A→B________________;
B→C___________。
(2)列舉下列物質的一種主要用途:
A_____________;
B_________________。
(3)在上述物質轉化關系圖中的化學反應里,沒有元素化合價變化的是______(用“A→B”這樣的形式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置(氣密性良好),若先將甲中液體滴入丙中,觀察到氣球明顯鼓起,一段時間后恢復原狀;再將乙中液體滴入丁中,氣球又明顯鼓起。下列組合正確的是( )

選項 | 滴管甲 | 燒杯丙 | 滴管乙 | 燒杯丁 |
A | 雙氧水 | 二氧化錳 | 水 | 氫氧化鈣 |
B | 稀硫酸 | 鎂 | 鹽酸 | 碳酸鈣 |
C | 水 | 氫氧化鈉 | 水 | 硝酸銨 |
D | 水 | 氧化鈣 | 鹽酸 | 鎂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中含有MgSO4和Na2SO4兩種溶質,選擇適當試劑將溶液中的鎂離子轉化為沉淀或固體分離出來,設計實驗流程如下:

(1)欲證明濾液中存在SO42-、CO32-,選用的方案是先取少量的濾液滴加過量的____,發現有氣泡生成,再向其中加入_____溶液,出現白色沉淀,則可證明SO42-、CO32-均存在。
(2)如何檢驗MgCO3沉淀是否洗滌干凈?____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為某石英晶體的平面結構示意圖,它實際上是立體網狀結構(可以看作晶體硅中的每個Si—Si鍵中插入一個O)。在石英晶體中,氧原子與硅原子的個數的比值和由硅原子、氧原子鐵石構成的最小環上Si、O的原子個數之和分別是( )

A.1 8B.2 12C.1/2 8D.1/2 12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組采用如圖所示裝置,對濃硝酸與木炭的反應進行探究(已知:4HNO34NO2↑+O2↑+2H2O)。

請回答下列問題:
(1)檢查裝置氣密性后,將燃燒匙中的木炭在酒精燈上加熱至紅熱狀態,伸入三口燒瓶中,并塞緊瓶塞,滴加濃硝酸,可觀察到三口燒瓶中氣體的顏色為________,產生該氣體的化學方程式是____________。
(2)裝置C中盛有足量Ba(OH)2溶液,熾熱的木炭與濃硝酸反應后可觀察到C中出現白色沉淀,該白色沉淀為____________(填化學式)。
(3)裝置B的作用是__________________________。
(4)裝置D中收集到了無色氣體,部分同學認為是NO,還有部分同學認為是O2。
①下列對該氣體的檢驗方法合適的是________。
A.敞口觀察裝置D中集氣瓶內氣體的顏色變化
B.將濕潤的藍色石蕊試紙伸入集氣瓶內,觀察藍色石蕊試紙是否變紅
C.將帶火星的木條伸入集氣瓶中,觀察木條是否復燃
②如果D中集氣瓶中收集的無色氣體是氧氣,則氧氣的來源是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一種集強氧化性、吸附、絮凝于一體的新型多功能處理劑,其生產工藝如圖所示:
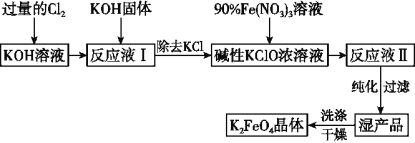
已知K2FeO4具有下列性質:
①可溶于水、微溶于濃KOH溶液
②在0~5 ℃、強堿性溶液中比較穩定
③在Fe3+和Fe(OH)3催化作用下發生分解
④在酸性至堿性條件下,能與水反應生成Fe(OH)3和O2
請完成下列填空:
(1)已知Cl2與KOH在較高溫度下反應生成KClO3。在不改變KOH溶液的濃度和體積的條件下,生產KClO應在溫度___________的情況下進行(填“較高”或“較低”)。
(2)生產K2FeO4的反應原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),則該反應中氧化劑與還原劑的物質的量之比為______________。
(3)K2FeO4在弱堿性條件下能與水反應生成Fe(OH)3和O2,則該反應的化學方程式為________________。
(4)在“反應液Ⅰ”中加KOH固體的目的是___________。
A. 為下一步反應提供反應物
B. 與“反應液Ⅰ”中過量的Cl2繼續反應,生成更多的KClO
C. KOH固體溶解時會放出較多的熱量,有利于提高反應速率
D. 使副產物KClO3轉化為KCl
(5)制備K2FeO4時,須將90%的Fe(NO3)3溶液緩慢滴加到堿性的KClO濃溶液中,并且不斷攪拌。采用這種混合方式的原因是_______________________ (答出1條即可)。
(6)從“反應液Ⅱ”中分離出K2FeO4晶體后,可以得到的副產品有________ (寫化學式)。
(7)工業上常用“間接碘量法”測定高鐵酸鉀樣品中高鐵酸鉀的含量,其方法是:用堿性的碘化鉀溶液(pH為11~12)溶解3.96 g高鐵酸鉀樣品,調節pH為1,避光放置40分鐘至反應完全(高鐵酸根離子全部被還原成鐵離子),再調節pH為3~4(弱酸性)。以1.0 mol/L的硫代硫酸鈉標準溶液為滴定劑進行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),當達到滴定終點時,用去硫代硫酸鈉標準溶液15.00 mL,則原高鐵酸鉀樣品中高鐵酸鉀的質量分數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于反應能量的說法正確的是
A. 若反應A=B △H<0,說明A物質比B物質穩定,分子內共價鍵鍵能 A比B大
B. 500 ℃、30 Mpa下,將0.5 mol N2和1.5 mol H2置于密閉的容器中充分反應生成NH3(g), 放熱 akJ,熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H= -2a kJmol-1
2NH3(g) △H= -2a kJmol-1
C. 101kPa時,2H2(g)+O2(g)==2H2O(g);△H=-QkJ·mol-1,則H2的燃燒熱為1/2QkJ·mol-l
D. 化學反應中,吸熱反應不一定需要加熱也能發生
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com