
【題目】隨著建筑裝飾材料進入百姓家庭,某些裝飾不久的居室由于裝飾材料釋放出來的污染物濃度過高,影響人體健康.這些污染物最常見的是( )
A.一氧化碳
B.二氧化硫
C.臭氧
D.甲醛、苯等揮發性有機物
 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】資源的高效利用對保護環境、促進經濟持續健康發展具有重要作用,如回收利用電解精煉銅的陽極泥中含有的銀、鉑、金等貴重金屬。提煉陽極泥的方法有多種,濕法提煉是其中重要的一種,其主要生產流程如下:
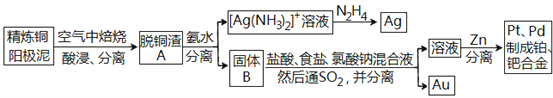
請回答下列問題:
(1)各步生產流程中都涉及了同一種分離方法,該方法需要的玻璃儀器有玻璃棒和_______。
(2)脫銅渣A中含有AgCl,它溶于濃氨水的離子方程式為________________。
(3)已知N2H4被銀氨溶液氧化的產物是氮氣,則每生成1molAg,需要消耗_______g N2H4。
(4)固體B中單質Au在酸性環境下與NaClO3、NaCl反應生成NaAuCl4;在NaAuCl4中Au元素的化合價為______,該反應的離子方程式為____________________。
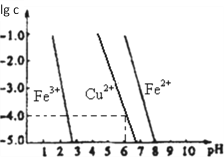
(5)陽極泥中的銅可以用FeC13溶液浸出,所得溶液主要含有的陽離子為Cu2+、Fe3+和Fe2+;結合如圖分析:(其中的縱坐標代表金屬陽離子濃度的對數)
①要從浸出液中提純銅,最好先加入酸化的雙氧水,目的是_______________,然后加入適量的CuO調節pH=3.7,除去______離子;
②從圖中數據計算可得Cu(OH)2的Ksp約為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作不能用于檢驗NH3的是( )
A. 氣體使濕潤的酚酞試紙變紅 B. 氣體使濕潤的紅色石蕊試紙變藍
C. 氣體與濃硫酸靠近 D. 氣體與濃鹽酸靠近
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組在實驗室探究二氧化氮與水的反應,實驗過程如下:

實驗一:制取二氧化氮
(1)在圖1裝置中用銅與濃硝酸反應制取并收集二氧化氮。在加入藥品前,必須進行的實驗操作是______________;圖l裝置的缺點是_______________。
實驗二:二氧化氮溶于水
(2)將盛滿二氧化氮的試管A倒扣入水中(如圖2),輕輕晃動試管,一段時間后觀察到的現象是_________________________;反應的化學方程式是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體可能含有NH4+、Cu2+、Na+、Cl﹣、CO32﹣、SO42﹣中的幾種離子,取等質量的兩份該固體,進行如下實驗(不考慮鹽類的水解及水的電離);
①一份固體溶于水得無色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入過量稀鹽酸,沉淀沒變化.
②另一份固體與過量NaOH固體混合后充分加熱,產生使濕潤的紅色石蕊試紙變藍色的氣體0.672L(保準狀況).
下列說法正確的是( )
A.該固體中一定含有NH4+、SO42﹣、Na+
B.該固體中一定沒有Cu2+、Cl﹣
C.該固體中只含有NH4+、CO32﹣、SO42﹣、Cl﹣
D.根據以上實驗,無法確定該固體中有Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cl2與NaOH溶液反應可生成NaCl、NaClO和NaClO3(Cl﹣和ClO﹣)的比值與反應的溫度有關,用40gNaOH配成的250mL溶液,與Cl2恰好完全反應(忽略Cl2與水的反應、鹽類的水解及溶液體積變化):
(1)NaOH溶液的物質的量濃度molL﹣1;
(2)某溫度下,反應后溶液中c(Cl﹣)=6c(ClO﹣),則溶液中c(ClO﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表的一部分,下列說法中,正確的是( )
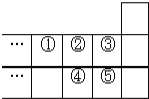
A. 元素的最高正化合價:![]()
B. 一定條件下,①和②的單質都只能形成一種氫化物
C. 38 g ③的單質跟足量水反應時,發生轉移的電子為1mol
D. 元素④在自然界中存在游離態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在一個小燒杯里加入約20g已研磨成粉末的氫氧化鋇晶體[Ba(OH)2·8H2O],將小燒杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入約10gNH4Cl晶體,并立即用玻璃棒迅速攪拌。使Ba(OH)2·8H2O與NH4Cl充分反應。實驗中觀察到的現象是______________________,說明該反應是___________熱反應,這是由于反應物所具有的總能量_________ (填“大于”、“小于”或“等于”生成物所具有的總能量。
(2)將Fe+2FeCl3=3FeCl2設計為一個原電池,則該電池的負極材料為__________,正極電極反應式為__________________________________。
(3)恒溫下,將amo1N2與bmolH2的混合氣體通入一容積固定的密閉容器中,發生如下反應:N2(g)+ 3H2(g)![]() 2NH3(g)。若反應進行到時刻t時,nt(N2)=13mol,nt(NH3)=6mol,則a=__________。反應達平衡時,混合氣體的體積為716.8L(已經折算為標準狀況下),其中NH3的體積分數為25%。則平衡時H2的轉化率為____________________。
2NH3(g)。若反應進行到時刻t時,nt(N2)=13mol,nt(NH3)=6mol,則a=__________。反應達平衡時,混合氣體的體積為716.8L(已經折算為標準狀況下),其中NH3的體積分數為25%。則平衡時H2的轉化率為____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com