
分析 ①A不溶于水和鹽酸判斷為硫酸鋇;
②B不溶于水但溶于鹽酸并放出無色無刺激性氣味的氣體E,判斷為二氧化碳,B為碳酸鹽;
③C的水溶液呈堿性,與硫酸反應生成A;與D反應生成B,推斷為氫氧化鋇;
④D可溶于水,與硫酸作用時放出氣體E,E可使澄清石灰水變渾濁,推斷為碳酸鹽
根據現象可推出E及B、D中含有的離子,再據物質溶解性可推出B、D,再由反應現象及轉化關系推出其他物質.
解答 解:(1)①A不溶于水和鹽酸,可知A為硫酸鋇;
②B不溶于水但溶于鹽酸并放出無色無刺激性氣味的氣體E,此氣體一定是二氧化碳,B為碳酸鋇;
③C的水溶液呈堿性,與硫酸反應生成硫酸鋇,可知A應該是氫氧化鋇;與碳酸鉀反應生成碳酸鋇;
④碳酸鉀可溶于水,與硫酸作用時放出氣體二氧化碳,二氧化碳可使澄清石灰水變渾濁;
通過分析,則E為二氧化碳;B、D均與酸反應生成E,且B不溶于水,則B為碳酸鋇,D為碳酸鉀;A不溶于水和鹽酸,由題給離子知只有硫酸鋇不溶于鹽酸,所以A為硫酸鋇;C的水溶液呈堿性,與硫酸反應生成A,則C為氫氧化鋇,
故答案為:BaSO4;BaCO3;Ba(OH)2;K2CO3;CO2.
點評 本題考查了物質性質和轉化的分析判斷,解答本題要根據物質轉化時的現象及物質的溶解性,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2017屆江蘇省南通市如東縣徐州市豐縣高三10月聯考化學卷(解析版) 題型:實驗題
七鋁十二鈣 (12CaO·7Al2O3)是一種新型的超導材料和發光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后鍛燒沉淀制備。工業上制備AlC13溶液用圖示流程(已知A1C13易升華)。

(1)輕燒后的氣體用水處理前導氣管為何要保溫?
(2)用水處理添加的試劑X是 ,其目的是 。
(3)AlC13溶液溶解CaCO3時,要控制碳酸鈣和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是 。用氨水沉淀、過濾后的濾液主要成分是 。
(4)以工業碳酸鈣(含有少量A12O3、Fe3O4雜質)生產二水合氯化鈣(CaC12·2H2O)的方法為:將工業碳酸鈣溶于鹽酸,加入雙氧水, 。(實驗中需用到的試劑和儀器有:鹽酸,雙氧水,氫氧化鈣,冰水,pH計)。
已知:幾種離子生成氫氧化物沉淀pH(開始沉淀的pH按金屬離子濃度為1.0mol/L計算)
開始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
補全實驗步驟: 冰水洗滌,干燥,得到CaC12·2H2O。
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第一次聯考化學試卷(解析版) 題型:實驗題
一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在;  鈷以Co2O3 ·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中回收氧化鈷(CoO)的工藝流程如下:
鈷以Co2O3 ·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中回收氧化鈷(CoO)的工藝流程如下:
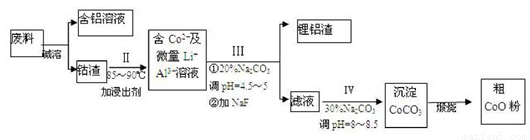
(1)過程I中采用NaOH溶液溶出廢料中的Al,反應的離子方程式為 。
(2)過程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷.則浸出鈷的離子反應方程式為(產物中只有一種酸根) 。在實驗室模擬工業生產時,也可用鹽酸代替酸化的Na2S2O3,但實際工業生產中不用鹽酸,請從反應原理分析不用鹽酸浸出鈷的主要原因 。
(3)用離子方程式表示過程III和IV中Na2CO3的主要作用 。
(4)CoO溶于鹽酸可得粉紅色的CoCl2溶液.CoCl2含結晶水數目不同而呈現不同顏色,利用藍色的無水CoCl2 吸水變色這一性質可制成變色水泥和顯隱墨水.圖2是粉紅色的CoCl2·6H2O晶體受熱分解時,剩余固體質量隨溫度變化的曲線,A物質的化學式是 .

(5)某天然堿的化學式可表示為2Na2CO3·NaHCO3·2H2O,取少量該物質溶于水得稀溶液。下列有關該溶液中微粒的物質的量濃度關系 正確的是 (填序號)。
正確的是 (填序號)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.將該溶液與少量NaOH 溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化學反應速率與化學平衡
化學反應速率與化學平衡| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 實驗編號 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| i | 150 | $\frac{1}{3}$ | 0.1 |
| ii | 150 | $\frac{1}{3}$ | 5 |
| iii | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬在潮濕的空氣中腐蝕的實質是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金屬的化學腐蝕的實質是:M-ne-═Mn+,電子直接轉移給還原劑 | |
| C. | 金屬的化學腐蝕必須在酸性條件下進行 | |
| D. | 在潮濕的中性環境中金屬的電化學腐蝕主要是吸氧腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
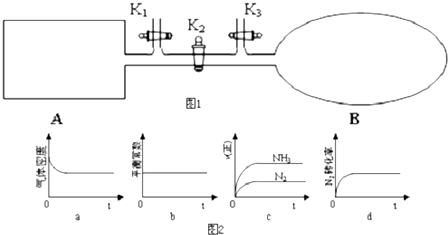
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有X、Z、W三種含14個電子的粒子,其結構特點如下:
有X、Z、W三種含14個電子的粒子,其結構特點如下:| 粒子代碼 | X | Z | W |
| 原子核數目 | 單核 | 同種元素構成的兩核 | 同種元素構成的兩核 |
| 粒子的電性 | 電中性 | 兩個單位負電荷 | 電中性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com