
 科學研究小組對氨基甲酸銨(NH2COONH4)的分解和水解反應進行探究.
科學研究小組對氨基甲酸銨(NH2COONH4)的分解和水解反應進行探究.分析 (1)①根據反應NH2COONH4(s)?2NH3(g)+C02(g)及平衡常數的概念寫出該反應的平衡常數表達式;
②達到平衡狀態特征時,正逆反應速率相等,各組分濃度不再變化,據此進行判斷;
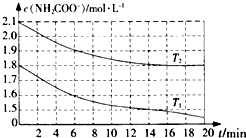
(2)①溫度T1時,0~6min氨基甲酸銨分解了(1.8-1.6)mol/L=0.2mol/L,據此計算分解率;根據v=$\frac{△c}{△t}$計算NH2COO-平均水解速率;
②根據在0~6min時段,T1、T2反應速率相同,但是溫度T2的起始濃度大于T1進行判斷;
(3)已知:①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由蓋斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),據此分析.
解答 解:(1)①NH2COONH4(s)?2NH3(g)+C02(g)的平衡常數表達式K=[NH3]2•[C02],
故答案為:[NH3]2•[C02];
②A.v正(NH3)=2v逆(CO2),證明正逆反應速率相等,達到了平衡狀態,故A正確;
B.容器中混合氣體的體積不變:由于容器的容積不變,則混合氣體的總體積不變,無法判斷是否達到平衡狀態,故B錯誤;
C.容器內壓強不變,說明混合氣體的物質的量不再變化,則正逆反應速率相等,達到了平衡狀態,故C正確;
D.反應中氨氣和二氧化碳的體積之比為2:1,則容器中氨氣的體積分數始終不變,無法判斷是否達到平衡狀態,故D錯誤;
故答案為:AC;
(2)①根據圖象可知,溫度T1時,0~6min氨基甲酸銨分解了(1.8-1.6)mol/L=0.2mol/L,則其分解率為:$\frac{0.2mol/L}{1.8mol/L}$×100%≈11.11%;
NH2COO-平均水解速率為:v=$\frac{0.2mol/L}{6min}$=0.03mol/(L•min),
故答案為:11.11%;0.03mol/(L•min);
②圖象中縱坐標為c(NH2COO-),橫坐標為時間,在0~6min時段,T1、T2反應速率相同,但是溫度T2的起始濃度大于T1,說明溫度T1>T2,
故答案為:>;在0~6min時段,T1、T2反應速率相同,但是溫度T2的起始濃度大于T1,說明溫度T1>T2;
(3)已知:①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由蓋斯定律:①×2-②×3得2N2(g)+6H2O(l)=4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1,
故答案為:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530 kJ•mol-1.
點評 本題考查了化學平衡狀態的判斷、化學反應速率的計算、熱化學方程式的計算,題目難度中等,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及化學計算能力,注意明確蓋斯定律的含義及應用方法,熟練掌握化學平衡狀態的判斷方法.


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | $\frac{a+b}{5}×100%$ | B. | $\frac{2(a+b)}{5b}×100%$ | C. | $\frac{2(a+b)}{5}×100%$ | D. | $\frac{a+b}{5a}×100%$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
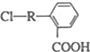 (其中R為飽和烴基),X在一定條件下如圖所示的轉化關系,已知Q的蒸氣密度是相同條件下H2密度的74倍,分子組成符號CaHbO2
(其中R為飽和烴基),X在一定條件下如圖所示的轉化關系,已知Q的蒸氣密度是相同條件下H2密度的74倍,分子組成符號CaHbO2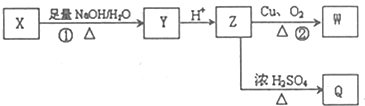
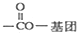 ),寫出任意一種能發生銀鏡反應的符合上述條件的物質的結構簡式
),寫出任意一種能發生銀鏡反應的符合上述條件的物質的結構簡式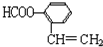
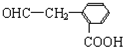 .于由X通過一步反應得到P,該反應的化學方程式是
.于由X通過一步反應得到P,該反應的化學方程式是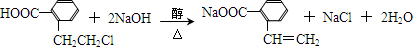
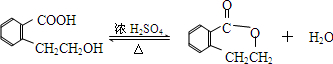 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
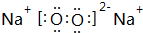 ,該化合物是由離子和共價鍵形成.
,該化合物是由離子和共價鍵形成.| 實驗步驟 | 實驗現象 |
| ①將E單質用砂紙打磨后,放入試管中,加入少量水后,加熱至水沸騰;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色. |
| ②向新制的Na2G溶液中滴加新制的單質H的水溶液 | 2.有氣體產生,溶液變成淺紅色 |
| ③將一小塊金屬D放入滴有酚酞溶液的冷水中 | 3.劇烈反應,迅速產生大量無色氣體. |
| ④將單質E投入稀鹽酸中 | 4.反應開始不十分劇烈,產生無色氣體. |
| ⑤將單質F投入稀鹽酸中 | 5.生成白色膠狀沉淀,繼而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至過量 | 6.生成淡黃色沉淀. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
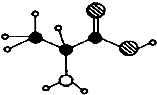
| A. | 能與濃硝酸作用顯黃色 | |
| B. | 在一定條件下,可以發生聚合反應生成高分子化合物 | |
| C. | 與鹽酸不反應 | |
| D. | 與NaHCO3溶液不反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈣離子的結構示意圖: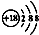 | B. | 乙烯的結構簡式:CH2CH2 | ||
| C. | CH4分子的球棍模型: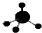 | D. | -CH3(甲基)的電子式為: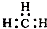 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com