
| 物質 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
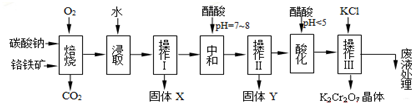
分析 鉻鐵礦通過焙燒,發生的反應有4FeO•Cr2O3+8Na2CO3+7O2 $\frac{\underline{\;750℃\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3 2NaAlO2+CO2↑,所以得到的固體中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固體Fe2O3、MgO和溶液Na2CrO4、NaAlO2,難溶性固體和溶液采用過濾方法分離,所以操作I是過濾,得到的X成分為Fe2O3、MgO,濾液中成分是Na2CrO4、NaAlO2;向濾液中加入醋酸并調節溶液的pH為7-8,使偏鋁酸鹽完全轉化為Al(OH)3沉淀,然后采用過濾方法除去氫氧化鋁沉淀,所以操作II是過濾,得到的Y為Al(OH)3,繼續調節溶液的pH為小于5,使CrO42-轉化為Cr2O72-,最后向所得溶液中加入氯化鉀,生成溶解度極小的K2Cr2O7,
(1)分離難溶性固體和溶液采用過濾方法;
(2)溶解度大的物質能轉化為溶解度小的物質;
(3)從溶液中獲取晶體的方法是:加入KC1固體、蒸發濃縮、冷卻結晶、過濾、洗滌、干燥;
(4)氫氧化鋁能溶于強堿溶液,向溶液中通入過量二氧化碳,能將偏鋁酸鹽轉化為Al(OH)3沉淀,灼燒氫氧化鋁固體得到Al2O3,再根據Al原子守恒計算其含量;
(5)根據I2+2S2O32-=2I-+S4O62-中碘和硫代硫酸根離子之間關系式計算碘的物質的量,再根據Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O中碘和Cr2O72-之間的關系式計算Cr2O72-的量,從而計算其純度.
解答 解:鉻鐵礦通過焙燒,發生的反應有4FeO•Cr2O3+8Na2CO3+7O2 $\frac{\underline{\;750℃\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3 $\frac{\underline{\;750℃\;}}{\;}$2NaAlO2+CO2↑,所以得到的固體中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固體Fe2O3、MgO和溶液Na2CrO4、NaAlO2,難溶性固體和溶液采用過濾方法分離,所以操作I是過濾,得到的X成分為Fe2O3、MgO,濾液中成分是Na2CrO4、NaAlO2;
向濾液中加入醋酸并調節溶液的pH為7-8,使偏鋁酸鹽完全轉化為Al(OH)3沉淀,然后采用過濾方法除去氫氧化鋁沉淀,所以操作II是過濾,得到的Y為Al(OH)3,繼續調節溶液的pH為小于5,使CrO42-轉化為Cr2O72-,最后向所得溶液中加入氯化鉀,生成溶解度極小的K2Cr2O7,
(1)分離難溶性固體和溶液采用過濾方法,通過以上分析知,操作I為過濾,
故答案為:過濾;
(2)溶解度大的物質能轉化為溶解度小的物質,根據表中數據知,四種物質中K2Cr207的溶解度最小,Na2Cr207的溶解度比K2Cr207大,所以在溶液中能發生反應Na2Cr207+2KCl=K2Cr207↓+2NaCl,
故答案為:K2CrO7 的溶解度比Na2Cr2O7小;
(3)從溶液中獲取晶體的方法是:加入KC1固體、蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,
故答案為:冷卻結晶;洗滌;
(4)氫氧化鋁能溶于強堿溶液,所以溶解氫氧化鋁的試劑是NaOH溶液;向溶液中通入過量二氧化碳,能將偏鋁酸鹽轉化為Al(OH)3沉淀,灼燒氫氧化鋁固體得到Al2O3,n(Al2O3)=$\frac{ng}{102g/mol}$,根據Al原子守恒得n[Al(OH)3]=2n(Al2O3)=$\frac{n}{51}$mol,則氫氧化鋁質量分數=$\frac{\frac{n}{51}mol×78g/mol}{mg}$×100%=$\frac{26n}{17m}$×100%,
故答案為:NaOH溶液;CO2; $\frac{26n}{17m}$×100%;
(5)根據I2+2S2O32-=2I-+S4O62-中碘和硫代硫酸根離子之間關系式得n(I2)=$\frac{0.1000mol/L×0.0474L}{2}$×1=0.00237mol,再根據Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O得n(Cr2O72-)=$\frac{1}{3}$n(I2)=$\frac{1}{3}$×0.00237mol=0.00079mol,250mL重鉻酸鉀中n(Cr2O72-)=0.0079mol,
m(K2Cr2O7)=0.0079mol×294g/mol=2.3226g,
其純度=$\frac{2.3226g}{2.5g}$×100%=92.9%,
故答案為:92.9%.
點評 本題考查物質的制備、物質含量的測定等知識點,為高考高頻點,側重考查基本操作、元素化合物知識、計算能力等,明確流程圖中每一步發生的反應及操作方法,難點是(5)題計算,正確判斷重鉻酸鉀和硫代硫酸根離子之間關系即可解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
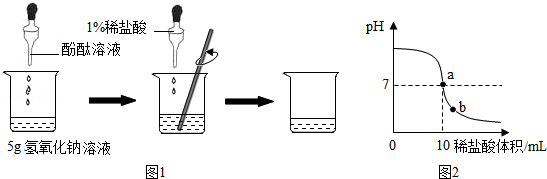
 已知連二次硝酸(H2N2O2)是一種二元酸,25℃時,用0.01mol.L-1的鹽酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH與鹽酸體積[V(HCl)]的關系如圖所示.下法說法正確的是( )
已知連二次硝酸(H2N2O2)是一種二元酸,25℃時,用0.01mol.L-1的鹽酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH與鹽酸體積[V(HCl)]的關系如圖所示.下法說法正確的是( )| A. | M點的溶液中加人少量水,溶液的pH增大 | |
| B. | N點溶液中:c(N2O22-)+c(OH-)>c(H2N2O2) | |
| C. | P點溶液中,H2O不發生電離 | |
| D. | 溶液中$\frac{c({H}^{+})}{c(H{N}_{2}{{O}_{2}}^{-})}$:N>P>Q. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
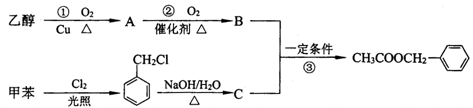
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中子數為20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子結構示意圖: | D. | Na2S的電子式 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
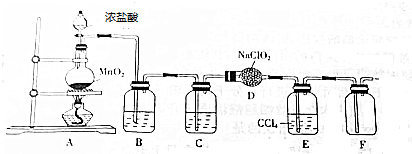
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
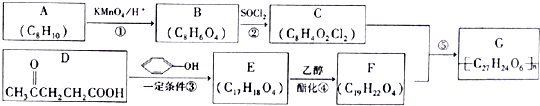
 →
→ +HCl
+HCl ;
;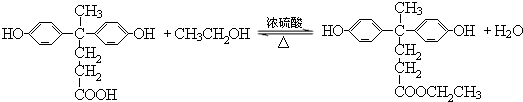 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.4L CO | B. | 4.4g CO2 | C. | 8 g SO3 | D. | 24.5g H2SO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com