
【題目】(1)常溫下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子發生電離,則溶液的pH= ;可以使0.10 mol·L-1 CH3COOH的電離程度增大的是
a.加入少量0.10 mol·L-1的稀鹽酸
b.加熱CH3COOH溶液
c.加水稀釋至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化鈉固體
f.加入少量0.10 mol·L-1的NaOH溶液
(2)將等質量的鋅投入等體積且pH均等于3的醋酸和鹽酸溶液中,經過充分反應后,發現只在一種溶液中有鋅粉剩余,則生成氫氣的體積:V(鹽酸)_________V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,則H2A的電離方程式為 。
(4)25℃時,將pH=9的NaOH溶液與pH=4的鹽酸溶液混合,若所得混合溶液的pH=6,則NaOH溶液與鹽酸溶液的體積比為 。
【答案】(1)3 bcf (2)< (3)H2A![]() H++HA-(4)9∶1
H++HA-(4)9∶1
【解析】
試題分析:(1)根據c(H+)=c(HAc)×ɑ,則c(H+)=0.1×1%,pH=3;醋酸溶液中存在電離平衡CH3COOH![]() CH3COO-+H+。a、加入鹽酸增大了溶液c(H+),對醋酸的電離起抑制作用,a錯誤;b、弱電解質的電離是吸熱反應,加熱,有利用向電離反應方向進行,b正確;c、加水稀釋,降低了濃度,根據勒夏特列原理,平衡向濃度增大的方向進行,即向電離反應進行,c正確;d、加入冰醋酸,電離程度降低,d錯誤;e、加入氯化鈉固體,對電離無影響,e錯誤;f、加入氫氧化鈉,消耗H+,促使平衡向電離方向進行,f正確。答案選bcf;
CH3COO-+H+。a、加入鹽酸增大了溶液c(H+),對醋酸的電離起抑制作用,a錯誤;b、弱電解質的電離是吸熱反應,加熱,有利用向電離反應方向進行,b正確;c、加水稀釋,降低了濃度,根據勒夏特列原理,平衡向濃度增大的方向進行,即向電離反應進行,c正確;d、加入冰醋酸,電離程度降低,d錯誤;e、加入氯化鈉固體,對電離無影響,e錯誤;f、加入氫氧化鈉,消耗H+,促使平衡向電離方向進行,f正確。答案選bcf;
(2)鹽酸是強酸,醋酸是弱酸,相同pH時,弱酸的濃度大于強酸,則鹽酸的物質的量小于醋酸,反應后只有一種溶液中有鋅剩余,此溶液是鹽酸,即產生氫氣的體積V(鹽酸) <V(醋酸);
(3)常溫下,0.1mol/L的某酸H2A的pH=4,說明該酸部分電離,則為弱酸,H2A是二元弱酸,分步電離,第一步電離方程式為:H2A![]() H++HA-;
H++HA-;
(4)25℃時,將pH=9的NaOH溶液與pH=4的鹽酸溶液混合,若所得混合溶液的pH=6,則鹽酸過量,則有:c(H+)混=![]() =
=![]() =10-6,則NaOH溶液與鹽酸溶液的體積比為9∶1。
=10-6,則NaOH溶液與鹽酸溶液的體積比為9∶1。


 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D、E五種物質中均含有同一種非金屬元素,他們能發生如圖所示的轉化關系。若該元素用R表示,則A為R的氧化物,D與NaOH溶液反應生成C和H2。
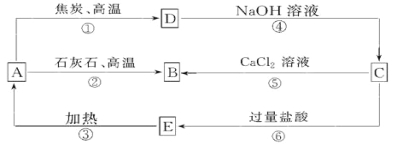
請回答:
(1)寫出對應物質的化學式:A__________; C__________; E__________。
(2)反應①的化學方程式為: 。
(3)反應④的離子方程式為: 。
(4)H2CO3的酸性強于E的,請用離子方程式予以證明: _________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某酸性溶液中含有Ba2+、Fe3+,則下述離子組中能與上述離子共存的是( )。
A. CO32—、Cl— B. NO3—、Cl—
C. NO3—、SO42— D. OH—、NO3—
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列做法不能減少大氣污染的是
A.大力發展清潔能源,煙氣脫硫
B.大力發展私家車,減少公共交通
C.利用太陽能、風能等替代化石能源
D.提倡多使用自行車
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關H2SO4的敘述正確的是( )
A.H2SO4的相對分子質量是98g/mol
B.1molH2SO4的質量是98g
C.1molH2SO4中含有1molH2
D.1molH2SO4中共含有6.02×1023個原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學平衡常數K、電離平衡常數Ka、水的離子積常數Kw的說法中錯誤的是
A. 各常數的大小與溫度有關 B. 各常數的大小說明平衡體系正反應的程度大小
C. 若溫度升高則各常數一定增大 D. 各常數越大反應物平衡轉化率越大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求寫方程式
(1)用鋁箔包一小塊鈉放入足量水中,寫出有關反應的離子方程式: ;
(2)實驗室制氫氧化鋁的離子方程式: ;
(3)氫氧化亞鐵在空氣中變為紅褐色的化學方程式: ;
(4)生成四氧化三鐵的置換反應的化學方程式: ;
(5)寫出氯化鐵溶液腐蝕由高分子材料銅箔復合而成的印刷電路板的化學方程式: ;
(6)寫出過氧化鈉用于呼吸面具或潛水艇中氧氣來源涉及的化學方程式: ;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com