
| 時間/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |

分析 (1)該反應為吸熱反應,根據溫度對平衡移動的影響判斷平衡常數的大小;
(2)先根據二氧化氮物質的量計算20s內反應的四氧化二氮的物質的量,進而計算20s時容器內四氧化二氮的物質的量,再計算20s~40s參加反應的四氧化二氮的物質的量,再根據速率定義式計算四氧化二氮的平均反應速率;根據平衡轉化率=$\frac{已轉化的物質的量}{起始的物質的量}$×100%;該反應正反應是吸熱反應,降低溫度平衡向逆反應方向移動,NO2濃度減小;
(3)根據圖(2)可知,t1時逆反應速率大于正反應速率,由圖(3)可知,t1時正逆反應速率都減小,且逆反應速率大于正反應速率,平衡逆向移動,由圖(4)可知,t1時正逆反應速率都增大,且逆反應速率大于正反應速率,平衡逆向移動,據此答題.
解答 解:(1)該反應為吸熱反應,升高溫度,平衡向正反應方程移動,平衡常數增大,所以K3>K1>K2,
故答案為:K3>K1>K2;
(2)20s時△n(NO2)=0.24mol,故△n(N2O4)=$\frac{1}{2}$△n(NO2)=$\frac{1}{2}$×0.24mol=0.12mol,所以a=0.4mol-0.12mol=0.28mol,故20s~40s參加反應的四氧化二氮的物質的量為0.28mol-0.2mol=0.08mol,所以20s-40s內用N2O4表示的平均反應速率為$\frac{\frac{0.08mol}{2L}}{20s}$=0.002mol/(L•S);
N2O4(g)?2NO2(g)
起始(mol) 0.40 0
已轉化(mol) 0.30 0.60
平衡(mol) 0.10 0.60
N2O4的平衡轉化率=$\frac{0.30}{0.40}$×100%=75%;
該反應正反應是吸熱反應,降低溫度平衡向逆反應方向移動,NO2濃度減小,氣體的顏色變淺,
故答案為:0.002;75%;變淺;
(3)根據圖(2)可知,t1時逆反應速率大于正反應速率,所以此時反應逆向進行,由圖(3)可知,t1時正逆反應速率都減小,且逆反應速率大于正反應速率,平衡逆向移動,所以此時改變的條件是減小壓強,由圖(4)可知,t1時正逆反應速率都增大,且逆反應速率大于正反應速率,平衡逆向移動,此時改變的條件是升高溫度,
故答案為:正反應;減小壓強,升高溫度.
點評 本題考查化學平衡圖象、化學反應速率及化學平衡影響因素,題目難度中等,注意掌握溫度、壓強、濃度、催化劑等對化學反應速率、化學平衡以及對平衡常數的影響,試題側重考查學生讀圖提取信息能力與知識遷移運用能力.


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
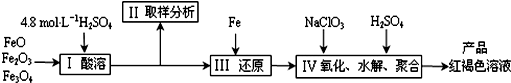
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定濃度的氨水加水稀釋的過程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值減小 | |
| B. | 濃度均為0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:[c(CO32-)>c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常溫下0.4mol/LHB溶液和0.2mol/LNaOH溶液等體積混合后溶液的pH=3,則溶液中微粒濃度存在下面關系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | 假設HClO的電離平衡常數為Ka,碳酸的電離常數分別記為:Ka1 和Ka2,已知:Ka1>Ka>Ka2,則發生反應:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室蒸餾自來水得到少量蒸餾水的裝置示意圖如圖2,請根據圖示回答下列問題:
如圖為實驗室蒸餾自來水得到少量蒸餾水的裝置示意圖如圖2,請根據圖示回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1、2 | B. | 1、1 | C. | 2、1 | D. | 2、3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將40g NaOH固體溶解于1L水中 | |
| B. | 將22.4L氯化氫氣體溶于水配成lL溶液 | |
| C. | 將1L 10mol/L的濃鹽酸與9L水混合 | |
| D. | 20g NaOH固體溶解在水中配成500mL溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .E的周期表中的位置:第三周期第ⅥA族.
.E的周期表中的位置:第三周期第ⅥA族.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com