
分析 將8g鐵粉置于40mlHNO3溶液中,發生的反應有:Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,
反應后鐵過量,則繼續發生:2Fe3++Fe=3Fe2+,最后得到溶液為Fe(NO3)2,反應的鐵的質量為:8g-2.4g=5.6g,根據反應的有關方程式結合元素守恒鐵以及電子守恒進行計算.
解答 解:(1)反應的鐵的質量為:8g-2.4g=5.6g,則n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
將10g鐵粉置于40mlHNO3溶液中,發生的反應有:Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+NO↑+4H2O,反應后鐵過量,則繼續發生:2Fe3++Fe=3Fe2+,最后得到溶液為Fe(NO3)2,所以,未被還原的HNO3的物質的量為n(HNO3)=2n(Fe)=2×0.1mol=0.2mol,則被還原的硝酸的物質的量為:$\frac{1.792L}{22.4L/mol}$=0.08mol,所以該反應中被還原和未被還原的HNO3的物質的量之比為:0.08mol:0.2mol=2:5,等于質量之比.
答:該反應中被還原和未被還原的HNO3的質量之比為2:5;
(2)設混合氣體中NO為xmol,NO2為ymol,則有:3x+y=2×0.1(電子守恒)x,x+y=0.08(N元素守恒),解得x=0.06mol.y=0.02mol.相同條件下,氣體的物質的量之比等于體積之比,則NO、NO2體積比為3:1,答:NO、NO2體積比為3:1.
點評 本題考查化學方程式的有關計算,題目難度不大,注意有關反應方程式的書寫,從守恒的角度解答.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:選擇題
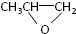 和CO2反應生成可降解聚合物
和CO2反應生成可降解聚合物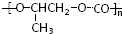 ,該反應符合綠化學的原則.
,該反應符合綠化學的原則.| A. | ①②③⑤ | B. | ①③④ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
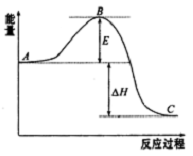 2SO2(g)+O2 (g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1molSO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2 (g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1molSO3(g)的△H=-99kJ•mol-1查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
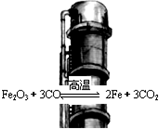
| A. | 升高溫度,反應速率減慢 | |
| B. | 當反應達到化學平衡時,υ(正)=υ(逆)=0 | |
| C. | 提高煉鐵高爐的高度可減少尾氣中CO的濃度 | |
| D. | 某溫度下達到平衡時,CO的體積分數基本不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 )加氫產物1,2-二甲基環乙烷(
)加氫產物1,2-二甲基環乙烷( )的一氯代產物有(不考慮立體異構)( )
)的一氯代產物有(不考慮立體異構)( )| A. | 3種 | B. | 4種 | C. | 5種 | D. | 6種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
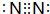 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KAl(SO4)2 | B. | NH4Al(SO4)2 | C. | (NH4)2Fe(SO4)2 | D. | NH4Fe(SO4)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 非金屬元素的原子最外層電子數都大于或等于4 | |
| B. | 只有非金屬能形成含氧酸或含氧酸鹽 | |
| C. | Na2O2中陰陽離子的個數比為1:1 | |
| D. | 非金屬元素組成的化合物不一定是共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgCl水溶液的導電性很弱,所以AgCl是弱電解質 | |
| B. | 所有鹽類都能促進水的電離 | |
| C. | 碳酸鈉溶液加水稀釋過程中,溶液中各離子濃度都減小 | |
| D. | 將1 mL pH=3的HX溶液稀釋到10 mL,若溶液的pH<4,則HX為弱酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com