
| A. | 向FeBr2洛液中通入足量氯氣:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | Cl2通入水中:Cl2+H20═2H++Cl-+ClO- | |
| C. | 用銅作電極電解CuSO4溶液:2Cu2++2H20═2Cu+O2+4H+ | |
| D. | 明礬溶液中滴入Ba(OH)2溶液使S042-恰好完全沉淀:2Ba2++3OH-+Al3++2S042-═2BaS04+Al(OH)3 |
分析 A.氯氣足量,二價鐵離子、溴離子都被氧化;
B.次氯酸為弱酸應保留化學式;
C.銅為陽極,為活性電極,電極本身放電;
D.硫酸根離子恰好沉淀時,鋁離子與氫氧根離子的物質的量之比為1:4,二者反應生成偏鋁酸根離子;
解答 解:A.向FeBr2洛液中通入足量氯氣,離子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故A正確;
B.Cl2通入水中,離子方程式:Cl2+H20═H++Cl-+HClO,故B錯誤;
C.用銅作電極電解CuSO4溶液,陽極銅失去電子生成銅離子,故C錯誤;
D.明礬[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸鋁鉀與氫氧化鋇的物質的量之比為1:2,反應生成偏鋁酸鈉,正確的離子方程式為:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D錯誤;
故選:A.
點評 本題考查了離子方程式的判斷,為中等難度的試題,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法是解題關鍵,注意離子反應遵循原子個數守恒、電荷守恒,注意化學式的拆分,注意反應物用量對反應的影響,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水玻璃可用于生產黏合劑和防火劑 | |
| B. | 誤服重金屬鹽,立即服用牛奶或豆漿可解毒 | |
| C. | 油脂、乙酸乙酯都屬于酯類,但不是同系物 | |
| D. | 蔗糖、淀粉、纖維素水解的最終產物都只是葡萄糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題



查看答案和解析>>
科目:高中化學 來源: 題型:解答題
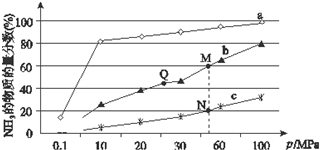 合成氨反應是化學上最重要的反應之一:
合成氨反應是化學上最重要的反應之一:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
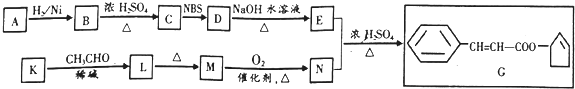
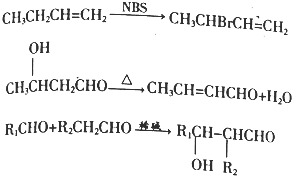
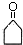
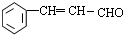 +O2$→_{△}^{催化劑}$2
+O2$→_{△}^{催化劑}$2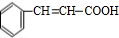
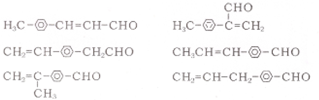 任意一種.
任意一種.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用明礬可以對水進行消毒、殺菌 | |
| B. | 為加快漂白精的漂白速率,使用時可滴加幾滴醋酸 | |
| C. | 浸泡過高錳酸鉀溶液的硅藻土放于新鮮的水果箱內是為了催熟水果 | |
| D. | 信息產業中的光纜的主要成分是單質硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com