
【題目】CO2和甲烷催化合成CO和H2是CO2資源化利用的有效途徑。主要反應為
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
寫出CH4和水蒸氣反應生成CO2的熱化學方程式_________。
(2)在恒溫、恒容的密閉容器中發生反應I,下列選項能夠說明反應I達到平衡狀態的是______。
A.混合氣體的密度不變
B.混合氣體的總壓強不變
C.CH4、CO2、CO、H2的物質的量之比為1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合氣體的平均相對分子質量不變
(3)催化合成的溫度通常維持在550-750℃之間,從反應速率角度分析其主要原因可能是_________。
(4)將CH4與CO2各1mol充入某密閉容器中,發生反應I。100Kpa時,反應I到達平衡時CO2的體積分數與溫度的關系曲線如圖所示。
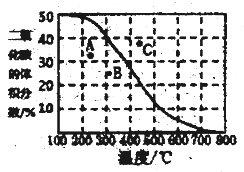
①圖中A、B、C三點表示不同溫度、壓強下達到平衡時CO2的體積分數,則______點對應的平衡常數最小,判斷依據是________;__________點對應的壓強最大。
②300℃,100Kpa下,該容器中反應I經過40min達到平衡,計算反應在0-40min內的平均反應速率為v(CO2)=_________mol/min(結果保留兩位有效數字),該溫度下的壓強平衡常數Kp=________。
(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
【答案】 CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165kJ/mol BE 在該溫度范圍內,催化劑的活性較大,反應速率快(合理即給分) A 反應I吸熱反應,溫度降低,平衡常數減小 C 2.8×10-3 6.25KPa2
CO2(g)+4H2(g) ΔH=+165kJ/mol BE 在該溫度范圍內,催化劑的活性較大,反應速率快(合理即給分) A 反應I吸熱反應,溫度降低,平衡常數減小 C 2.8×10-3 6.25KPa2
【解析】(1)已知:①CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
②CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
根據蓋斯定律可知①×2-②即得到CH4和水蒸氣反應生成CO2的熱化學方程式為CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165kJ/mol。(2)A. 密度是混合氣的質量和容器容積的比值,在反應過程中質量和容積始終是不變的,因此混合氣體的密度不變不能說明,A錯誤;B.正反應體積增大,則混合氣體的總壓強不變說明反應達到平衡狀態,B正確;C.CH4、CO2、CO、H2的物質的量之比為1:1:2:2不能說明正逆反應速率相等,則不一定處于平衡狀態,C錯誤;D.3V正(H2)=V逆(CH4)不能滿足反應速率之比是化學計量數之比,沒有達到平衡狀態,D錯誤;E. 混合氣的平均相對分子質量是混合氣的質量和混合氣的總的物質的量的比值,質量不變,但物質的量是變化的,所以混合氣體的平均相對分子質量不變說明反應達到平衡狀態,E正確;答案選BE;(3)催化劑的活性受溫度影響較大,因此主要原因可能是在該溫度范圍內,催化劑的活性較大,反應速率快。(4)①由于反應I吸熱反應,溫度降低,平衡常數減小,所以A點對應的平衡常數最小;C點溫度最高,反應物轉化率最大,由于正反應體積增大,則C點對應的壓強最大。②根據方程式可知:
CO2(g)+4H2(g) ΔH=+165kJ/mol。(2)A. 密度是混合氣的質量和容器容積的比值,在反應過程中質量和容積始終是不變的,因此混合氣體的密度不變不能說明,A錯誤;B.正反應體積增大,則混合氣體的總壓強不變說明反應達到平衡狀態,B正確;C.CH4、CO2、CO、H2的物質的量之比為1:1:2:2不能說明正逆反應速率相等,則不一定處于平衡狀態,C錯誤;D.3V正(H2)=V逆(CH4)不能滿足反應速率之比是化學計量數之比,沒有達到平衡狀態,D錯誤;E. 混合氣的平均相對分子質量是混合氣的質量和混合氣的總的物質的量的比值,質量不變,但物質的量是變化的,所以混合氣體的平均相對分子質量不變說明反應達到平衡狀態,E正確;答案選BE;(3)催化劑的活性受溫度影響較大,因此主要原因可能是在該溫度范圍內,催化劑的活性較大,反應速率快。(4)①由于反應I吸熱反應,溫度降低,平衡常數減小,所以A點對應的平衡常數最小;C點溫度最高,反應物轉化率最大,由于正反應體積增大,則C點對應的壓強最大。②根據方程式可知:
CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol)1 1 0 0
轉化量(mol)x x 2x 2x
平衡量(mol)1-x 1-x 2x 2x
300℃,100Kpa下平衡時CO2體積分數是0.4,則![]() ,解得x=1/9,則在0-40min內的平均反應速率為v(CO2)=1/(9×40)=2.8×10-3mol/min,該溫度下的壓強平衡常數Kp=
,解得x=1/9,則在0-40min內的平均反應速率為v(CO2)=1/(9×40)=2.8×10-3mol/min,該溫度下的壓強平衡常數Kp=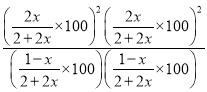 =6.25KPa2。
=6.25KPa2。


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案科目:高中化學 來源: 題型:
【題目】下列推論正確的是( )
A. SiH4的沸點高于CH4,可推測PH3的沸點高于NH3
B. NH![]() 為正四面體結構,可推測PH
為正四面體結構,可推測PH![]() 也為正四面體結構
也為正四面體結構
C. CO2晶體是分子晶體,可推測SiO2晶體也是分子晶體
D. C2H6是碳鏈為直線形的非極性分子,可推測C3H8也是碳鏈為直線形的非極性分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質分類正確的是( )
A. SO2、SiO2、CO均為酸性氧化物
B. 稀豆漿、硅酸、氯化鐵溶液均為膠體
C. 燒堿、冰醋酸、四氯化碳均為電解質
D. 漂白粉、水玻璃、氨水均為混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】奧運會籃球比賽用球男女有別。男子籃球比賽用7#球,內部空間體積大約是7.35 L,比賽時內部壓強約為170 kPa。己知,在25℃,100 kPa時,氣體摩爾體積約為24.5 L/mol。假設比賽場館溫度為25℃,下列說法中正確的是
A.比賽時,籃球內一般充填氮氣
B.比賽時,籃球內約有空氣0.3 mol
C.比賽時,籃球內約有空氣14.8 g
D.當25℃,170kPa時,Vm>24.5 L/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫常壓下,將三個分別盛滿氨氣、氯化氫與空氣體積比為3∶1的混合氣、二氧化氮的等容積燒瓶,再分別倒置于盛水的水槽中,當水進入燒瓶中,并使氣體充分溶解后,假定燒瓶中溶液無損失,所得溶液的物質的量濃度之比為
A.1∶1∶1 B.5∶5∶4 C.1∶2∶3 D.1∶1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制250 mL 0.10 mol·L-1的NaOH溶液時,下列實驗操作會使配得的溶液濃度偏大的是
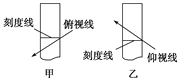
A. 轉移溶液后未洗滌燒杯和玻璃棒就直接定容
B. 轉移溶液時,有液體飛濺
C. 在容量瓶中定容時俯視刻度線
D. 定容后把容量瓶倒轉搖勻,發現液面低于刻度,再補充幾滴水至刻度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.相對分子質量相同的幾種化合物,互為同分異構體
B.分子組成相差一個或幾個CH2原子團的物質,互為同系物
C.C5H11Cl的同分異構體(不考慮立體異構)共有8種
D.淀粉與纖維素是化學式為(C6H10O5)n的同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種因素:①溫度和壓強 ②所含微粒數 ③微粒本身大小 ④微粒間的距離,其中對氣態物質體積有顯著影響的是( )
A. ②③④ B. ②④ C. ①③④ D. ①②④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com