
【題目】焦亞硫酸鈉(Na2S2O5)是常用的脫氧劑,其制備方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定條件下NaHSO3轉化為Na2S2O5。完成下列填空:
(1)碳原子的原子結構示意圖是_____________;CO2的化學鍵類型_______________________。
(2)從原子結構的角度,解釋氧元素的非金屬性比硫元素強的原因。______________________。
(3)SO2與Na2CO3溶液反應生成NaHSO3和CO2,其化學方程式為_____________________,證明NaHSO3溶液中HSO3-的電離程度大于水解程度,可采用的實驗方法是________________。
(4)Na2S2O5作脫氧劑時的反應原理為Na2S2O5+O2+H2O→Na2SO4+H2SO4,該反應中,氧化產物是_____;若反應中轉移了0.04mol的電子,有____g Na2S2O5參加反應。
(5)連二亞硫酸鈉Na2S2O4俗稱保險粉,廣泛用于紡織工業的還原性染色、清洗、印花、脫色以及織物的漂白等。Na2S2O4屬于強還原劑,暴露于空氣中易被氧氣氧化。Na2S2O4遇KMnO4酸性溶液發生反應:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。為了測定保險粉純度。稱取5.0g Na2S2O4樣品溶于冷水中,配成100mL溶液,取出10mL該溶液于錐形瓶中,用0.1000mol/L的KMnO4溶液滴定。重復上述操作2次,平均消耗KMnO4溶液21.00mL。則該樣品中Na2S2O4的質量分數為________(雜質不參與反應)。(保留至0.1%)
【答案】 ![]() 極性共價鍵 氧原子和硫原子最外層電子數相等,但是氧原子的半徑比硫原子小,核對核外電子的吸引力強,得電子能力強,所以氧元素非金屬性比硫強 2SO2+Na2CO3+H2O=2NaHSO3+CO2 取樣,測定溶液的pH,若pH小于7,說明電離程度大于水解程度 Na2SO4、H2SO4 1.90 60.9%
極性共價鍵 氧原子和硫原子最外層電子數相等,但是氧原子的半徑比硫原子小,核對核外電子的吸引力強,得電子能力強,所以氧元素非金屬性比硫強 2SO2+Na2CO3+H2O=2NaHSO3+CO2 取樣,測定溶液的pH,若pH小于7,說明電離程度大于水解程度 Na2SO4、H2SO4 1.90 60.9%
【解析】(1)碳原子核電荷數為6,,原子結構示意圖是![]() ;CO2為共價化合物,碳氧原子間形成2條共價鍵,由于碳氧原子的電負性不同,所以CO2分子內化學鍵類型為極性共價鍵;正確答案:
;CO2為共價化合物,碳氧原子間形成2條共價鍵,由于碳氧原子的電負性不同,所以CO2分子內化學鍵類型為極性共價鍵;正確答案: ![]() ; 極性共價鍵。
; 極性共價鍵。
(2)雖然氧原子和硫原子最外層電子數相等,但是氧原子的半徑比硫原子小,核對核外電子的吸引力強,得電子能力強,所以氧元素非金屬性比硫強;正確答案:氧原子和硫原子最外層電子數相等,但是氧原子的半徑比硫原子小,核對核外電子的吸引力強,得電子能力強,所以氧元素非金屬性比硫強。
(3)亞硫酸的酸性大于碳酸,SO2與Na2CO3溶液反應生成NaHSO3和CO2,其化學方程式為2SO2+Na2CO3+H2O=2NaHSO3+CO2;HSO3-的電離過程溶液顯酸性,HSO3-的水解過程溶液顯堿性,要證明HSO3-的電離程度大于水解程度,就可以證明該溶液顯酸性即可;實驗方法是取樣,用pH試紙測定溶液的pH,若pH小于7,說明電離程度大于水解程度;正確答案:2SO2+Na2CO3+H2O=2NaHSO3+CO2;取樣,測定溶液的pH,若pH小于7,說明電離程度大于水解程度。
(4)Na2S2O5中硫元素為+4價,被氧化為Na2SO4和H2SO4,SO2-4中硫均為+6價,因此氧化產物是Na2SO4、H2SO4;由1mol氧氣得電子變為-2價的氧可知,該反應轉移電子4mol,根據反應關系可知:Na2S2O5--O2-4e-,若反應中轉移了0.04mol的電子,消耗Na2S2O5的量為0.01mol,質量為190×0.01=1.9 g;正確答案:Na2SO4、H2SO4;1.90。
(5)Na2S2O4遇KMnO4酸性溶液發生反應生成Na2SO4、K2SO4、MnSO4,則硫元素共升高6價,錳元素共降低5價,化合價升降應相同,故關系為:5S2O42----6MnO4- ,10mL溶液中消耗KMnO4的量為21×10-3×0.1mol,則100mL溶液消耗KMnO4的量為21×10-3×0.1×10mol,由此可知樣品中Na2S2O4的量為5/6×21×10-3×0.1×10mol=0.0175 mol, Na2S2O4的質量為0.0175×174 g,該樣品中Na2S2O4的質量分數為0.0175×174/5×100%= 60.9%;正確答案:60.9%。


科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)已知:氫氣的燃燒熱ΔH=-285.8 kJ/mol,則氫氣燃燒的熱化學方程式可表示為_____。
(2)如圖所示是101kPa時氫氣在氯氣中燃燒生成氯化氫氣體的能量變化,此反應的熱化學方程式為________________。

(3)已知:1 mol水蒸氣變成液態水放熱44 kJ,結合本題(1)、(2)信息,推知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】面對目前世界范圍內的能源危機,甲醇作為一種較好的可再生能源,具有廣泛的應用前景。
(1)已知在常溫常壓下反應的熱化學方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
寫出由二氧化碳、氫氣制備甲醇的熱化學方程式:_______________________。
(2)在容積為V L的容器中充入a mol CO與2a mol H2,在催化劑作用下反應生成甲醇,平衡時的轉化率與溫度、壓強的關系如圖所示。

①p1________p2(填“大于”、“小于”或“等于”);
②在溫度和容積不變的情況下,再增加a mol CO與2a mol H2,達到新平衡時,CO的轉化率________(填“增大”、“減小”或“不變”,下同),平衡常數________。
(3)關于CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90 kJ·mol-1 正確的是_____________________
CH3OH(g) ΔH1=-90 kJ·mol-1 正確的是_____________________
A.溫度和壓強一定時,混合氣體的密度不再變化,證明已經達到平衡狀態
B. 2V(CO)正= V(H2)逆
C.溫度和體積一定時,容器內壓強不變,證明已經達到平衡狀態
D.百分比組成2W(CO)=W(H2),證明已經達到平衡狀態
E.混合氣體的平均相對分子質量不再改變的狀態,證明已經達到平衡狀態
F.溫度越高越有利于該反應自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物F( )為一種高分子樹脂,物質C的分子式為:C10H10Obr2;F的合成路線如下:
)為一種高分子樹脂,物質C的分子式為:C10H10Obr2;F的合成路線如下:

已知:①A為苯甲醛的同系物,分子中無甲基,其相對分子質量為134;
②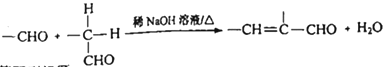
請回答下列問題:
(1)X的化學名稱是_____________________________________。
(2)E生成F的反應類型為___________________________________。
(3)D的結構簡式為________________________________。
(4)由B生成C的化學方程式為______________________________________。
(5)芳香族化合物Y是D的同系物,Y的同分異構體能與飽和Na2CO3溶液反應放出氣體,分子中只有1個側鏈,核磁共振氫譜顯示有5種不同化學環境的氫,峰值面積比為6:2:2:1:1。寫出兩種符合要求的Y的結構簡式____________、________________________。
(6)寫出以甲醛、丙醛和乙二醇為主要原料合成軟質隱形眼鏡高分子材料-聚甲基丙烯酸羥乙酯( )的合成路線(無機試劑自選):__________________________。
)的合成路線(無機試劑自選):__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料是人類生存和發展的物質基礎,合理使用材料可以改善人類生活。下列有關材料的說法中正確的是
A. 棉、麻、絲、毛及合成纖維完全燃燒都只生成C02和H20
B. 金屬材料都是導體,非金屬材料都是絕緣體
C. 天然橡膠通過硫化可增大強度和彈性
D. 玻璃是混合物,有固定的熔點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用少量的溴和足量的乙醇制備1,2-二溴乙烷。制備裝置如下圖:

下列說法中不正確的是( )
A. 使用恒壓滴液漏斗的目的是防止有機物揮發,使漏斗內液體順利滴下
B. 實驗中為了防止有機物大量揮發,應緩慢升高反應溫度到170℃
C. 裝置C 中應加入氫氧化鈉溶液,以吸收反應中可能生成的酸性氣體
D. 實驗過程中應用冷水冷卻裝置D,以避免溴的大量揮發
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,有關物質的電離平衡常數如下:
化學式 | CH3COOH | H2CO3 | H2SO3 |
電離平衡常數 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)請寫出H2SO3的電離平衡常數K1的表達式:________________。
(2) 常溫下,將體積為10mL pH=2的醋酸溶液與亞硫酸溶液分別加蒸餾水稀釋至1000mL,稀釋后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定條件下,冰醋酸加水稀釋過程中溶液導電能力I隨加水體積V變化曲線如右圖所示,則a、b、c三點溶液醋酸的電離程度由大到小為____________________。

(4)下列離子CH3COO-、CO32-、HSO3-、SO32-在溶液中結合H+的能力由大到小的關系為___________。
(5)體積相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三種酸溶液分別與同濃度的NaOH溶液完全中和時,消耗NaOH溶液的體積由大到小的排列順序是_____(填序號)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。實驗測得稀醋酸與稀NaOH溶液反應生成1 mol H2O時放出57 kJ的熱,則醋酸溶液中,醋酸電離的熱化學方程式為________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com