
【題目】COCl2 (g) ![]() CO(g)+Cl2 (g) △H>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO 的濃度 ④加催化劑 ⑤恒壓通入惰性氣體,能提高COCl2 轉化率的是( )
CO(g)+Cl2 (g) △H>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO 的濃度 ④加催化劑 ⑤恒壓通入惰性氣體,能提高COCl2 轉化率的是( )
A.①⑤ B.①② C.③⑤ D.②④
 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】莽草酸是一種合成治療禽流感藥物達菲的原料,鞣酸存在于蘋果、生石榴等植物中。下列關于這兩種有機化合物的說法正確的是( )
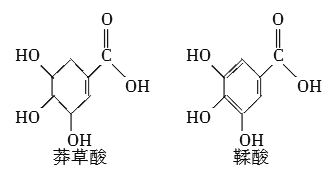
A.兩種酸都能與溴水發生加成反應
B.兩種酸與三氯化鐵溶液都能發生顯色反應
C.鞣酸分子與莽草酸分子相比多了兩個碳碳雙鍵
D.等物質的量的兩種酸與足量的金屬鈉反應產生氫氣的量相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某非金屬單質A經下圖所示的過程轉化為含氧酸D,已知D為強酸,請回答下列問題:
![]()
(1)若A常溫下為淡黃色固體,B是無色有刺激性氣味氣體。
①D的化學式:_______;
②寫出B→C反應的化學方程式:_________________;
③氯水和B皆可作漂白劑。若同時使用于漂白一種物質時,其漂白效果是_______(填“增強”“減弱”“不變”),用離子方程式解釋上述原因_______________。
(2)若A是一種能使濕潤的紅色石蕊試紙變藍的氣體,C是紅棕色氣體。
①A、C的化學式分別是:A_______,C_____________;
②寫出A→B反應的化學方程式:___________________;
③D的濃溶液在常溫下可與銅反應并生成C氣體,該反應的化學方程式為:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中石化于2012年將年產120萬噸的乙烯工程落戶大慶,乙烯是有機化工工業的重要原料,有很多重要用途。如:乙烯催化氧化成乙醛可設計成如下圖所示的燃料電池,在制備乙醛的同時還可獲得電能,其總反應化學方程式為:2CH2=CH2+O2→2CH3CHO。下列有關說法正確的是
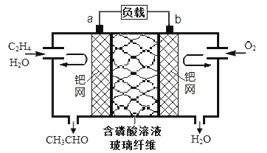
A. 該電池電極a為正極,b為負極
B. 電子移動方向:電極a→磷酸溶液→電極b
C. 負極反應式為:CH2=CH2-2e-+H2O=CH3CHO+2H+
D. b電極有2.24LO2反應,溶液中有0.4molH+遷移到b電極上反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1.
硫代硫酸鈉是一種重要的化工產品,某興趣小組擬制備硫代硫酸鈉晶體(Na2S2O3·5H2O)。
I.[查閱資料]
(1)Na2S2O3·5H2O是無色透明晶體,易溶于水,受熱、遇酸均反應,其稀溶液與BaCl2溶液混合無沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得產品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3難溶于水,可溶于稀HCl。
Ⅱ.[制備產品]實驗裝置如圖所示(省略夾持裝置):
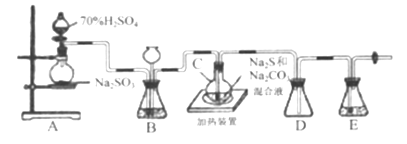
燒瓶C中發生反應如下:
Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq)
Na2S2O3(aq)
實驗步驟:
(1)檢查裝置氣密性。儀器組裝完成后,關閉兩端活塞,向裝置B的長頸漏斗內注入液體至形成一段液柱,若__________,則整個裝置氣密性良好:裝置E的作用是__________。
(2)按圖示加入試劑。向A中燒瓶滴加濃H2SO4,產生的氣體將裝置中空氣排盡后,再加熱C,A中反應的化學方程式是______;為提高產品純度,應使C中Na2CO3和Na2S恰好完全反應,則C燒瓶中Na2CO3和Na2S物質的量之比為_______ 。
(3)裝置B的另一作用是觀察SO2的生成速率,其中的液體最好選擇_____。
a.蒸餾水 b.飽和Na2SO3溶液 c.飽和NaHSO3溶液 d.飽和NaHCO3溶液
實驗中要控制SO2生成速率,使SO2緩慢進入C中可采取的措施有_______;為了保證硫代硫酸鉀的產量,該實驗一般控制在堿性環境下進行。否則產品發黃,原因是______。
(4)等Na2S和Na2CO3完全消耗后,結束反應。趁熱過濾C中混合物,將濾液水浴加熱濃縮、_____,經過濾、洗滌、干燥,得到產品。
Ⅲ.[探究與反思]
為驗證產品中含有Na2SO3和Na2SO4,該小組設計了以下實驗方案,請將方案補充完整。取適量產品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____(所需試劑從稀HNO3、稀H2SO4、稀HCl、蒸餾水中選擇),若沉淀未完全溶解,并有刺激性氣味的氣體產生,則可確定產品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 溶解度大的化合物一定是強電解質
B. 膠體與溶液的本質區別是分散劑粒子大小的不同
C. 物質在發生化學反應的過程中,都伴隨著能量的變化
D. 金屬的冶煉必須在高溫下進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定質量CaCl2和HCl的混合溶液中逐滴加入濃度為1.000 mol·L-1的Na2CO3溶液,反應過程中加入的Na2CO3溶液的體積與產生沉淀或氣體的質量關系如圖所示。
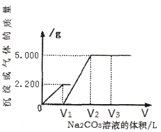
(1)樣品中物質的量之比n (CaCl2) :n(HCl)=_____________。
(2)V2=_____________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2L的密閉容器中發生反應:xA(g)+B(g)![]() 2C(g) △H<0,A、C的物質的量隨時間變化的關系如右表所示。下列有關說法正確的是
2C(g) △H<0,A、C的物質的量隨時間變化的關系如右表所示。下列有關說法正確的是

A. x=1
B. 反應開始2min內,用B表示的反應速率為0.05mol · L-l · min -1
C. 反應進行到lmin時,反應體系達到化學平衡狀態
D. A的正反應速率等于C的逆反應速率時,反應體系達到化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質與用途具有對應關系的是
A. 常溫下鐵能被濃硝酸鈍化,可用鐵制容器貯運濃硝酸
B. 明礬溶于水能形成膠體,可用于自來水的殺菌消毒
C. 濃硫酸有吸水性,可用于干燥二氧化硫和氨氣
D. 金屬鈉具有強還原性,可與TiCl4溶液反應制取金屬Ti
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com