
【題目】(1)鐵及其化合物在生活、生產中有廣泛的應用。請回答下列問題:
①黃鐵礦(FeS2)是生產硫酸和冶煉鋼鐵的重要原料。其中一個反應為3FeS2+8O2=6SO2+Fe3O4,氧化產物為_____,若有3mol FeS2參加反應,轉移__________mol電子。
②FeCl3與氫碘酸反應時可生成棕色物質I2,該反應的離子方程式為_________________。
(2)已知:S2O32-具有較強的還原性,實驗室可用I-測定測定K2S2O8樣品的純度:反應方程式為:
S2O82-+2I-→2SO42-+I2,I2+2S2O32-→2I-+S4O62-則S2O82-、S4O62-、I2氧化性強弱順序:_________.
(3) 已知溶液中:還原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物質的量的關系曲線如圖所示。
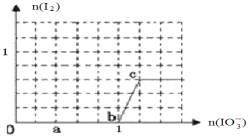
①寫出a點處還原產物是_______________;b點到c點反應的離子方程式_________________________。
②當溶液中的I-為0.5 mol時,加入的KIO3為___________mol。
【答案】SO2、Fe3O4322Fe3++2I-=2Fe2++I2S2O82->I2>S4O62-I-IO3-+5I-+6H+=3I2+3H2O0.5或1.1
【解析】
(1)①在反應3FeS2+8O2![]() 6SO2+Fe3O4中,FeS2中Fe、S元素的化合價升高,失去電子,被氧化,O2中的O元素的化合價降低,被還原,所以氧化產物為SO2、Fe3O4;3molFeS2參加反應,由O元素的化合價變化可知,轉移的電子為8mol×2×(2-0)=32mol;②FeC13與氫碘酸反應時可生成棕色物質是I2,根據電子守恒、電荷守恒及原子守恒,可得該反應的離子方程式為2Fe3++2I-=2Fe2++I2;(2)在氧化還原反應中氧化性:氧化劑>氧化產物,由S2O82-+2I-=2SO42-+I2可知氧化性:S2O82->I2;由I2+2S2O32-=2I-+S4O62-可知氧化性:I2>S4O62-.所以氧化性:S2O82->I2>S4O62-;(3)HSO3->I-,在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,首先發生反應:3HSO3-+IO3-=3SO42-+I-+3H+;HSO3-反應完畢,繼續加入KIO3,由于氧化性IO3->I2,再發生反應:IO3-+6H+ +5I- =3H2O+3I2。①由圖可知,a點沒有生成碘,故發生反應3HSO3-+ IO3-=3SO42-+I-+3H+,反應中S元素化合價升高,還原劑是HSO3-,I元素的化合價降低,I元素被還原,所以此處的還原產物是I-,由圖可知,b點到c點由于生成I2,故發生反應:IO3-+6H+ +5I-=3H2O+3I2。②當溶液中的I-為0.5mol時,有兩種情況:一是只發生反應3HSO3-+IO3-=3SO42-+I-+3H+,生成I-為0.5mol,根據碘元素守恒n(KIO3) =n(I-)=0.5mol;二是HSO3-反應完畢后,還發生IO3-+6H+ +5I-=3H2O+3I2,剩余I-為0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反應IO3-+6H+ +5I- =3H2O+3I2中消耗的I-為1mol-0.5mol=0.5mol,消耗KIO3的物質的量為0.5mol×1/5=0.1mol,故共加入的KIO3為1mol+0.1mol=1.1mol。
6SO2+Fe3O4中,FeS2中Fe、S元素的化合價升高,失去電子,被氧化,O2中的O元素的化合價降低,被還原,所以氧化產物為SO2、Fe3O4;3molFeS2參加反應,由O元素的化合價變化可知,轉移的電子為8mol×2×(2-0)=32mol;②FeC13與氫碘酸反應時可生成棕色物質是I2,根據電子守恒、電荷守恒及原子守恒,可得該反應的離子方程式為2Fe3++2I-=2Fe2++I2;(2)在氧化還原反應中氧化性:氧化劑>氧化產物,由S2O82-+2I-=2SO42-+I2可知氧化性:S2O82->I2;由I2+2S2O32-=2I-+S4O62-可知氧化性:I2>S4O62-.所以氧化性:S2O82->I2>S4O62-;(3)HSO3->I-,在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,首先發生反應:3HSO3-+IO3-=3SO42-+I-+3H+;HSO3-反應完畢,繼續加入KIO3,由于氧化性IO3->I2,再發生反應:IO3-+6H+ +5I- =3H2O+3I2。①由圖可知,a點沒有生成碘,故發生反應3HSO3-+ IO3-=3SO42-+I-+3H+,反應中S元素化合價升高,還原劑是HSO3-,I元素的化合價降低,I元素被還原,所以此處的還原產物是I-,由圖可知,b點到c點由于生成I2,故發生反應:IO3-+6H+ +5I-=3H2O+3I2。②當溶液中的I-為0.5mol時,有兩種情況:一是只發生反應3HSO3-+IO3-=3SO42-+I-+3H+,生成I-為0.5mol,根據碘元素守恒n(KIO3) =n(I-)=0.5mol;二是HSO3-反應完畢后,還發生IO3-+6H+ +5I-=3H2O+3I2,剩余I-為0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反應IO3-+6H+ +5I- =3H2O+3I2中消耗的I-為1mol-0.5mol=0.5mol,消耗KIO3的物質的量為0.5mol×1/5=0.1mol,故共加入的KIO3為1mol+0.1mol=1.1mol。


科目:高中化學 來源: 題型:
【題目】在某溫度下,將2molA和3molB充入一密閉容器中,發生反應:aA(g)+B(g) ![]() C(g)+D(g),5min后達到平衡,各物質的平衡濃度的關系為:ca(A)c(B)=c(C)c(D)。若在溫度不變的情況下將容器的體積擴大為原來的8倍,A的轉化率不發生變化,則B的轉化率為( )
C(g)+D(g),5min后達到平衡,各物質的平衡濃度的關系為:ca(A)c(B)=c(C)c(D)。若在溫度不變的情況下將容器的體積擴大為原來的8倍,A的轉化率不發生變化,則B的轉化率為( )
A. 60% B. 40% C. 50% D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗、現象及有關結論不正確的是
選項 | A | B | C | D |
實驗 |
|
|
|
|
現象 | 加熱鋁箔,鋁箔熔化卻不滴落 | 石蠟油分解產生的氣體能使試管中溴的四氯化碳溶液褪色 | 食鹽水浸泡過的鐵釘放入試管中,一段時間后,導管口形成一段水柱 | 向蔗糖中加人濃硫酸時,蔗糖變黑,體積膨脹 |
結論 | 氧化鋁的熔點比鋁的高 | 石蠟油的分解產物中含不飽和烴 | 鐵釘發生吸氧腐蝕 | 濃硫酸具有吸水性和強氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某次實驗需用480mL、0.5mol/L的稀H2SO4溶液,某同學用98%的濃H2SO4(ρ=1.84g/cm3)進行配制,請回答下列問題:
(1)實驗需要的玻璃儀器除了燒杯、量筒、玻璃棒,還有________________________;
(2)計算:98%的濃H2SO4(ρ=1.84g/cm3)的物質的量濃度為__________,配制本次實驗需要的稀硫酸需用量筒量取上述98%的濃H2SO4___________________ mL
(3)配制過程:①用量筒量取所需的濃硫酸
②將濃硫酸緩緩注入盛有適量蒸餾水的燒杯中,邊加邊攪拌
③用玻璃棒引流將燒杯中的溶液轉移到已經檢漏的合適規格的容量瓶中
④洗滌燒杯和玻璃棒2~3次,洗滌液也注入容量瓶中.輕輕搖動容量瓶,使溶液混合均勻
⑤向容量瓶中加入蒸餾水,在距離刻度1~2cm時,改用膠頭滴管加蒸餾水至刻度線
⑥蓋好瓶塞,反復上下顛倒,搖勻
⑦將配制好的溶液轉移至試劑瓶中待用。
上述配置溶液的步驟存在缺失,缺少的步驟是_____________________,應放在步驟_____之前進行(填“序號”)。
(4)在橫線上填寫下列各種情況對所配制溶液濃度的影響(選填“偏高”、“偏低”或“無影響”).
①所用的濃硫酸長時間放置在密封不好的容器中_________;
②量取濃硫酸所用量筒有蒸餾水_________;
③定容時,俯視液面_________;
④用量筒量取濃硫酸時仰視液面___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合物F筒稱PETA,可利用于新型的普適無鹵阻燃體系。圖是以A為原料合成聚合物F的路線:
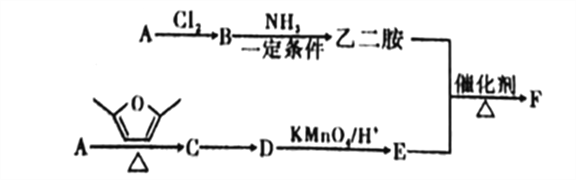
已知: ①A為與氫氣的相對密度是14的烴;
②![]() ;
;
③D、E均為芳香化合物,它們的核磁共振氫譜顯示均為2組峰。
回答下列問題:
(1)A中的官能團名稱為_______,B的名稱是______。
(2)B與NH3在一定條件的反應類型為___________。
(3)C的結構簡式為___________。
(4)由C轉化為D的反應中,除D外,另外一種生成物是___________。
(5)乙二胺和E反應生成聚合物F的化學方程式為___________,反應類型為___________。
(6)E的同分異構體中,滿足以下條件的共有_____種(不含立體異構)。
①遇到FeCl3溶液會顯色;②能發生銀鏡反應;③能與NaHCO3溶液反應。
(7)參照上述合成路線,以1,3-丁二烯為原料(無機試劑任選),設計制備![]() 的合成路線:_____________________________。
的合成路線:_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸是一種二元弱酸,可用作還原劑、絡合劑、掩蔽劑、沉淀劑。某校課外小組的同學設計利用C2H2氣體制取H2C2O4·2H2O。
回答下列問題:
(1)甲組的同學利用電石(主要成分CaC2,少量CaS及Ca3P2等)并用下圖裝置制取C2H2[反應原理為:CaC2+2H2O![]() Ca(OH)2+C2H2(g) △H<0,反應劇烈]:
Ca(OH)2+C2H2(g) △H<0,反應劇烈]:
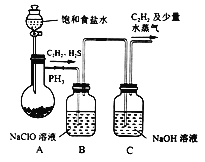
① 裝置A用飽和食鹽水代替水并緩慢滴入燒瓶中,其目的是__________。
② 裝置B中,NaClO將H2S、PH3氧化為硫酸及磷酸,本身還原為NaCl,其中H2S被氧化的離子方程式為________。
(2)乙組的同學根據文獻資料,用Hg(NO3)2作催化劑,濃硝酸氧化乙炔制取H2C2O4·2H2O。制備裝置如下:
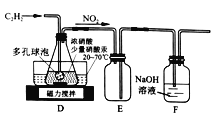
①裝置D多孔球泡的作用是_________;裝置E的作用是________。
②D中生成H2C2O4的化學方程式為_______。
③從裝置D得到產品,還需經過濃縮結晶、________(填操作名稱)洗滌及干燥。
(3)丙組設計了測定乙組產品在H2C2O4·2H2O的質量分數實驗。他們的實驗步驟如下:精確稱取m g產品于錐形瓶中,加入適量的蒸餾水溶解,在加入少量稀硫酸,然后用cmol/L酸性KMnO4標準溶液進入滴定,滴至溶液顯微紅色;共消耗標準溶液VmL。
①滴定時,KMnO4標準溶液盛放在__________滴定管中(填“酸式”或“堿式”)。
②滴定時KMnO4被還原Mn2+,其反應的離子方程式為_____,滴定過程中發現褪色速率先慢后逐漸加快,其主要原因是__________。
③產品中H2C2O4·2H2O的質量分數為_________(列出含m、c、v的表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵的化合物有廣泛用途,如碳酸亞鐵(FeCO3)可作為補血劑,鐵紅(Fe2O3)可作為顏料。利用某硫酸廠產生的燒渣(主要含Fe2O3、FeO,還有一定量的SiO2)制備FeCO3的流程如下:

(1)“酸溶”時加快反應速率的方法有______(寫出一種)。
(2)①“還原”時,FeS2與H2SO4不反應,Fe3+通過兩個反應被還原,其中一個反應如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,則另一個反應的離子方程式為_________。
+16H+,則另一個反應的離子方程式為_________。
②加入FeS2還原后,檢驗Fe3+是否反應完全的方法是______________________。
(3)①“沉淀”時,需要控制溫度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗滌,檢驗沉淀已洗凈的方法是______________。
(4)FeCO3濁液長時間暴露在空氣中,會有部分固體表面變為紅褐色,同時釋放出CO2,則與FeCO3反應的物質為_______(填化學式)。
(5)寫出在空氣中煅燒FeCO3制備高純氧化鐵的化學方程式:_________________。FeCO3在空氣中煅燒生成Fe2O3時,也會生成FeO。現煅燒23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,則Fe2O3的質量為____kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用過量的乙酸和異成醇制備乙酸異戊酯,原理(如圖所示) 和有關數據如下:
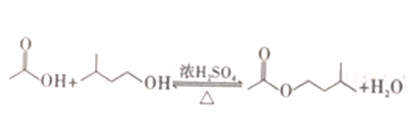
物質 | 相對分子質量 | 密度/(g·cm-3) | 熔點/℃ | 沸點/℃ | 水中溶解度 |
異戊醇 | 88 | 0.8123 | -117 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 17 | 118 | 溶 |
乙酸異戊酯 | 130 | 0.8670 | -78 | 142 | 難溶 |
下列說法正確的是
A. 常溫下,可用過濾的方法分離乙酸異戊酯和水溶液
B. 反應中,加入過量的乙酸的主要目的是加快該反應的反應速率
C. 為了除去產物中混有的乙酸,可以向混合物中加入足量飽和Na2CO3溶液,充分振蕩后靜置、分液
D. 為了除去產物中混有的異戊醇,應選擇如圖所示裝置中的c裝置
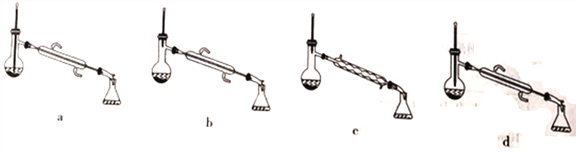
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為將混有K2SO4、MgSO4的KNO3固體提純,并制得KNO3溶液,某學生設計了如下實驗方案:

(1).操作①為__________。
(2).操作②~④所加試劑的溶質依次為__________。
(3).如何判斷SO42-已除盡?__________。
(4).實驗過程中產生的多種沉淀__________(填“需要”或“不需要”)多次過濾,其理由是__________。
(5).該同學的實驗設計方案是否嚴密?__________(填“嚴密”或“不嚴密”),請說明理由:__________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com