
【題目】下列污水處理的方法中,表示其原理的離子方程式不正確的是( )
A.混凝法,用明礬做混凝劑:Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用過量CO2中和堿性廢水:CO2+2OH-=CO32-
C.沉淀法,用Na2S處理含Hg2+廢水:Hg2++S2-=HgS↓
D.氧化還原法,用FeSO4將酸性廢水中Cr2O72—還原為Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
【答案】B
【解析】A.混凝法,用明礬做混凝劑,是因為鋁離子水解生成氫氧化鋁膠體,離子方程式為Al3+ + 3H2O ![]() Al(OH)3 + 3H+,故A不符合題意;
Al(OH)3 + 3H+,故A不符合題意;
B、過量CO2中和堿性廢水反應生成碳酸氫根:CO2 + OH-= HCO3-,故B符合題意;
C.用Na2S處理含Hg2+廢水生成硫化汞沉淀:Hg2+ + S2-= HgS↓,故C不符合題意;
D.FeSO4將酸性廢水中Cr2O72-還原為Cr3+,本身被氧化為鐵離子,Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,故D不符合題意。
故答案為:B
A.氯離子水解生成氫氧化鋁膠體;
B.過量二氧化碳與氫氧根離子反應生成碳酸氫鹽;
C.硫離子與汞離子反應生成硫化汞沉淀;
D.亞鐵鹽被氧化物鐵鹽,含鉻化合物被還原.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:
【題目】(一定溫度下,在三個體積約為1.0L的恒容密閉容器中發生反應:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列說法正確的是( )
容器 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.該反應的正方應為吸熱反應
B.達到平衡時,容器I中的CH3OH體積分數比容器Ⅱ中的小
C.容器I中反應達到平衡所需時間比容器Ⅲ中的長
D.若起始時向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,則反應將向正反應方向進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中,屬于強電解質的是___ __,屬于非電解質的是___ _____(均填序號)
①Cu②液氨③氯水④氯化鈉晶體⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金剛石⑩石墨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】As2O3在醫藥、電子等領域有重要應用.某含砷元素(As)的工業廢水經如圖1流程轉化為粗As2O3 . 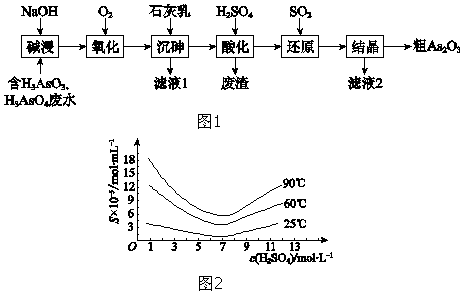
(1)“堿浸”的目的是將廢水中的H3AsO3和H3AsO4轉化為鹽.H3AsO4轉化為Na3AsO4反應的化學方程式是 .
(2)“氧化”時,1mol AsO33﹣轉化為AsO43﹣至少需要O2mol.
(3)“沉砷”是將砷元素轉化為Ca5(AsO4)3OH沉淀,發生的主要反應有: a.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
b.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
研究表明:“沉砷”的最佳溫度是85℃.
用化學平衡原理解釋溫度高于85℃后,隨溫度升高沉淀率下降的原因是 .
(4)“還原”過程中H3AsO4轉化為H3AsO3 , 反應的化學方程式是 .
(5)“還原”后加熱溶液,H3AsO3分解為As2O3 , 同時結晶得到粗As2O3 . As2O3在不同溫度和不同濃度硫酸中的溶解度(S)曲線如圖2所示.為了提高粗As2O3的沉淀率,“結晶”過程進行的操作是 .
(6)下列說法中,正確的是(填字母). a.粗As2O3中含有CaSO4
b.工業生產中,濾液2可循環使用,提高砷的回收率
c.通過先“沉砷”后“酸化”的順序,可以達到富集砷元素的目的.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用符號A:質子數,B:中子數,C:核外電子數,D:最外層電子數,E:電子層數,填寫下列各空。
(1)原子種類由_____決定。
(2)元素的種類由_____決定
(3)元素的化合價主要由____決定
(4)核電荷數由_____決定。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】探究并回答問題
(1)為了進一步研究硫酸銅的量對氫氣生成速率的影響,該同學設計了如下一系列實驗.將表中所給的混合溶液分別加入到6個盛有過量Zn粒的反應瓶中,收集產生的氣體,記錄獲得相同體積的氣體所需時間.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
飽和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①請完成此實驗設計,其中:V1= , V6= , V9=;
②反應一段時間后,實驗A中的金屬呈色,實驗E中的金屬呈色;
③該同學最后得出的結論為:當加入少量CuSO4溶液時,生成氫氣的速率會大大提高.但當加入的CuSO4溶液超過一定量時,生成氫氣的速率反而會下降.請分析氫氣生成速率下降的主要原因 .
(2)在100℃和200kPa的條件下,反應aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物質的條件下逐步增大體系的壓強(維持溫度不變),下表列出的不同壓強下反應建立平衡時物質B的濃度.
壓強(kPa) | 200 | 500 | 1 000 |
B的濃度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根據表中的數據,回答下列問題:
①壓強從200kPa增加到500kPa時,平衡移動(填“正向”“逆向”或“不”),理由是 .
②壓強從500kPa增加到1 000kPa時,平衡轉移(填“正向”“逆向”或“不”),其原因可能是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定條件下可實現下圖所示的變化。

請回答下列問題。
(1)B、C、D、E 4種物質的化學式為:
B____________、C____________、D____________、E____________。
(2)沉淀F與NaOH溶液反應的離子方程式為________________________________。
沉淀E與稀硫酸反應的離子方程為____________________________________。
溶液G與過量稀氨水反應的化學方程為________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com