
【題目】已知反應C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH在一定溫度和壓強下于密閉容器中達到平衡。下列敘述正確的是( )
CO(g)+H2(g) ΔH在一定溫度和壓強下于密閉容器中達到平衡。下列敘述正確的是( )
A.升高溫度,平衡常數K增大,則ΔH<0
B.縮小容器體積,c(CO)減小
C.恒壓條件下,充入一定量的氮氣,n(H2)增大
D.更換高效催化劑,H2O(g)的轉化率增大
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為0.1mol/L、體積不同的HA溶液與BOH 溶液混合,保持溶液的總體積為100 mL,溶液的體積與混合液pH 的關系如圖所示。下列說法正確的是

A. V1表示HA 溶液的體積,V2表示BOH 溶液的體積
B. Ka( HA) 和Kb( BOH) 的數量級相等,均為10-6
C. y點時,c(B+)=c(A-)=c(OH-)=c(H+)
D. x、y、z 所示三點時水的電離程度:y>x=z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,![]() 和
和![]() 的電離常數分別為
的電離常數分別為![]() 和
和![]() 。將
。將![]() 和體積均相同的兩種酸溶液分別稀釋,其
和體積均相同的兩種酸溶液分別稀釋,其![]() 隨加水體積的變化如圖所示。下列敘述正確的是( )
隨加水體積的變化如圖所示。下列敘述正確的是( )

A. 曲線Ⅰ代表![]() 溶液
溶液
B. 溶液中水的電離程度:b點>c點
C. 從c點到d點,溶液中 保持不變(其中
保持不變(其中![]() 、
、![]() 分別代表相應的酸和酸根離子)
分別代表相應的酸和酸根離子)
D. 相同體積a點的兩溶液分別與![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.金屬的晶胞如圖所示 ,其配位數為8
,其配位數為8
B.![]() 分子中,S原子的價層電子對數為3,中心原子上孤電子對數為1,S原子為
分子中,S原子的價層電子對數為3,中心原子上孤電子對數為1,S原子為![]() 雜化,是直線型分子
雜化,是直線型分子
C.醋酸鈉溶液中離子濃度的關系為:![]()
D.已知反應![]() ,某溫度下的平衡常數為400,此溫度下,在恒容密閉容器中加入一定量
,某溫度下的平衡常數為400,此溫度下,在恒容密閉容器中加入一定量![]() ,某時刻測得各組分濃度如表,則此時正、逆反應速率的大小關系為:
,某時刻測得各組分濃度如表,則此時正、逆反應速率的大小關系為:![]()
物質 |
|
|
|
濃度 |
|
|
|
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列圖示所得出的結論不正確的是

A. 圖甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數與反應溫度的關系曲線,說明該反應的ΔH<0
CO2(g)+H2(g)的平衡常數與反應溫度的關系曲線,說明該反應的ΔH<0
B. 圖乙是室溫下H2O2催化分解放出氧氣的反應中c(H2O2 )隨反應時間變化的曲線,說明隨著反應的進行H2O2分解速率逐漸減小
C. 圖丙是室溫下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲線,說明HX是一元強酸
D. 圖丁是室溫下用Na2SO4除去溶液中Ba2+達到沉淀溶解平衡時,溶液中c(Ba2+ )與c(SO42)的關系曲線,說明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:

已知:氣體分壓(P分)=氣體總壓(P總)×體積分數。下列說法正確的是
A. 550℃時,若充入惰性氣體,正,逆 均減小,平衡不移動
B. 650℃時,反應達平衡后CO2的轉化率為25.0%
C. T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動
D. 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數KP=24.0P總
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )與pH的關系如圖所示[假設c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列說法正確的是( )
)與pH的關系如圖所示[假設c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列說法正確的是( )
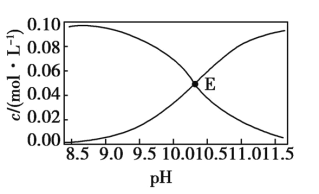
A.圖中E點溶液表示濃度均為0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E點溶液中加入等體積0.100 mol·L-1的NaOH溶液,c(![]() )與c(
)與c(![]() )之和保持不變
)之和保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,22.4 L二氯甲烷的共價鍵數為NA個
B.一定條件下,2 mol SO2和1 mol O2混合在密閉容器中充分反應后容器中的分子數大于2NA
C.含4.8 g碳元素的石墨晶體中的共價鍵數為1.2NA個
D.2 mL 0.5 mol/L FeCl3溶液滴入沸水中制備Fe(OH)3膠體,所得膠粒數目為0.001NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡態理論認為:化學反應并不是通過簡單的碰撞就能完成的,而是從反應物到生成物的過程中經過一個高能量的過渡態。如圖1為1molNO2與1molCO恰好反應生成CO2和NO過程中的能量變化示意圖

(1)試寫出NO2和CO反應的熱化學方程式:________
(2)在密閉容器中進行的上述反應是可逆反應,圖2是某學生模仿圖1畫出的NO+CO2 =NO2+CO的能量變化示意圖。則圖中E3=________kJmol-1
(3)在密閉容器中充入1molH2和1molI2 , 壓強為p(Pa),并在一定溫度下使其發生反應:H2(g)+I2(g)2HI(g)△H<0.保持容器內氣體壓強不變,向其中加入1molN2 , 反應速率________(填“變大”、“變小”或“不變”),平衡________移動(填“向正反應方向”、“向逆反應方向”或“不”)。
(4)T℃,向1L密閉容器中加入1molHI(g),發生反應2HIH2+I2, H2物質的量隨時間的變化如圖3所示。
①該溫度下,2HI(g)H2(g)+I2(g)的平衡常數K=________
②相同溫度下,若開始加入HI(g)的物質的量是原來的2倍,則________是原來的2倍。
a.平衡常數 b.HI的平衡濃度
c.達到平衡的時間 d.平衡時H2的體積分數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com