
【題目】二氯亞砜(SOCl2)是一種無色易揮發液體,與水劇烈水解生成兩種氣體,常用作脫水劑,其熔點-105℃,沸點79℃,140℃以上時易分解。
(1)用硫黃(用S表示)、液氯和三氧化硫為原料在一定條件合成氯化亞砜,原子利用率達100%,則三者的物質的量比為_______________。寫出SOCl2吸收水蒸氣的化學方程式:_______________________________。
(2)甲同學設計下圖裝置用ZnCl2·xH2O晶體制取無水ZnCl2,回收剩余的SOCl2并驗證生成物中含有SO2(夾持及加熱裝置略):
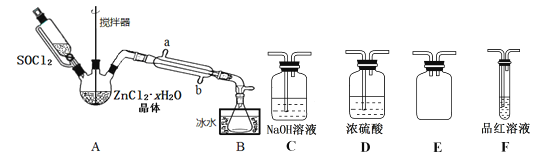
①裝置的連接順序為A→B→____→___→___→____。
②冷凝管的進水口是_______________。(填“a”或“b”)
③實驗結束,為檢測ZnCl2·xH2O晶體是否完全脫水,稱取蒸干后的固體ag溶于水,加入足量稀硝酸和硝酸銀溶液,過濾洗滌干燥,稱得固體為bg。若b/a=___(保留一位小數),即可證明ZnCl2·xH2O晶體已完全脫水。
④乙同學認為直接將ZnCl2·xH2O晶體置于坩堝中加熱灼燒即可得到無水ZnCl2,但大家說此方法不行,請解釋原因______________________。
(3)丙同學認為SOCl2還可用作由FeCl3·6H2O制取無水FeCl3的脫水劑,但丁同學認為該實驗會發生氧化還原反應。戊同學設計了如下實驗方案判斷丁同學的觀點:
取少量FeCl3 6H2O于試管中,加入SOCl2,振蕩使兩種物質充分反應;再往試管中加水溶解,滴加KSCN溶液,若沒有明顯現象,則證明脫水過程中發生了氧化還原反應。按照戊同學的思路方法,還可以選擇證明__________或______________(填離子符號)是否存在證明該過程是否發生了氧化還原反應。
【答案】 2:3 1 SOCl2+H2O=SO2↑+2HCl↑ D E F C b 2.1 會發生水解反應生產ZnO Fe2+、SO42-
【解析】(1)用硫黃(用S表示)、液氯和三氧化硫為原料在一定條件合成氯化亞砜,原子利用率達100%,2S+3Cl2 +SO3==3SOCl2,則三者的物質的量比為2:3:1;SOCl2遇水劇烈反應生成SO2與HCl,反應方程式為:SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收結晶水得到SO2與HCl,用冰水冷卻收集SOCl2,濃硫酸吸收水蒸氣,防止溶液中水蒸氣加入B中,用品紅溶液檢驗二氧化硫,用氫氧化鈉溶液吸收尾氣種二氧化硫與HCl,防止污染環境,E裝置防止倒吸,裝置的連接順序為A→B→D→F→E→C;
②攪拌可以增大接觸面積,加快脫水速率;溫度過高SOCl2會分解,應采取水浴加熱,受熱均勻,便于控制溫度;應整個冷凝管充滿冷凝水,充分冷卻,應從b口進水;
③ZnCl2xH2O完全脫水得到ZnCl2,則ag為ZnCl2的質量,溶于水后加入足量稀硝酸和硝酸銀溶液,過濾,洗滌,干燥,稱得固體為bg為AgCl的質量,由氯離子守恒:2ag/136g/mol= bg/143.5g/mol,b/a=2.1
④ZnCl2加熱時會水解為氫氧化鋅與HCl,氫氧化鋅受熱分解為ZnO,不能得到ZnCl2,該方案不可行;
(3)若發生氧化還原反應,則Fe3+會被還原為Fe2+,而SOCl2水解得到SO2會被氧化為H2SO4,實驗證明脫水時發生了氧化還原反應,只要證明. Fe2+或SO42-的存在。


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:
【題目】明礬石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,還含有雜質Fe2O3 . 利用明礬石來制取純凈的Al2O3、K2FeO4和H2SO4的工藝流程如圖所示. 
請回答下列問題:
(1)焙燒爐中發生反應的化學方程式為2Al2(SO4) ![]() 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 轉移的電子數目為 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 轉移的電子數目為 .
(2)生成沉淀I的離子方程式為 , 沉淀II的化學式為 .
(3)溶液經加硫酸調節pH后,過濾,洗滌,可得沉淀I,證明沉淀I已洗滌干凈的實驗操作和現象是 .
(4)寫出Cl2將沉淀Ⅱ氧化為K2FeO4的化學方程式: .
(5)從濾液中得到K2SO4晶體的方法是 .
(6)K2FeO4也可以鐵為電極,通過電解濃的KOH溶液來制取,寫出電解法制取K2FeO4的陽極反應式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】控制變量法是研究化學變化規律的重要思想方法。請仔細觀察下表中50 mL稀鹽酸和1 g碳酸鈣反應的實驗數據:
實驗序號 | 碳酸鈣狀態 |
| 溶液溫度/℃ | 碳酸鈣消失所需時間/s | |
反應前 | 反應后 | ||||
1 | 粒狀 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒狀 | 0.6 | 20 | 41 | 280 |
4 | 粒狀 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒狀 | 1.0 | 20 | 40 | 120 |
7 | 粒狀 | 1.0 | 30 | 50 | 40 |
8 | 粒狀 | 1.2 | 20 | 40 | 90 |
9 | 粒狀 | 1.2 | 25 | 45 | 40 |
分析并回答下列問題:
(1)本反應屬于 (填“吸熱”或“放熱”)反應,反應的離子方程式為 。
(2)實驗6和7表明, 對反應速率有影響, 反應速率越大,能表明同一規律的實驗還有
(填實驗序號)。
(3)根據實驗1、3、4、6、8可以得出條件對反應速率的影響規律是 。
(4)本實驗中影響反應速率的其他因素還有 ,能表明這一規律的實驗序號是1、2與 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】喹硫平是一種非經典抗精神疾病的藥物,對多種神經遞質受體有相互作用,其結構為 ,它的合成路線如下:
,它的合成路線如下:
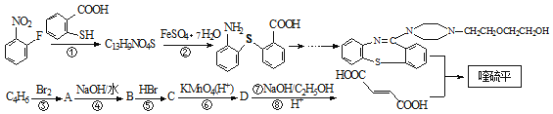
已知:(Ⅰ)反應①為取代反應;(Ⅱ)![]()
請回答下列問題:
(1)下列說法不正確的是__________
A.物質 ![]() 能發生氧化反應,不發生還原反應
能發生氧化反應,不發生還原反應
B.反應⑤的目的是保護碳碳雙鍵,防止被氧化
C.喹硫平的分子式為C46H52S2N6O8
D.1mol物質D最多能與3molNaOH反應
(2)分子式為C13H9NO4S的物質的結構簡式是___________________。
(3))物質OHCCH=CHCH=CH(CH2)4CHO的同分異構體有多種,寫出符合下列條件的所有同分異構體的結構簡式___________。
①與 FeCl3溶液反應顯紫色;②分子中含三個甲基;③核磁共振氫譜只有四個峰.
(4)已知:-SH(巰基)的性質與-OH相似,則![]() 在一定條件下發生縮聚反應的化學方程式為________________。
在一定條件下發生縮聚反應的化學方程式為________________。
(5) 是一種重要的有機化合物。請設計合理方案,完成從
是一種重要的有機化合物。請設計合理方案,完成從![]() 到
到 的合成路線流程圖(無機試劑任用)。_________________
的合成路線流程圖(無機試劑任用)。_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中科院化學所研制的晶體材料——納米四氧化三鐵,在核磁共振造影及醫藥上有廣泛用途,其生產過程的部分流程如下:
![]()
下列有關敘述不合理的是
A. 納米四氧化三鐵可分散在水中,它與FeCl3溶液的分散質直徑相當
B. 納米四氧化三鐵具有磁性,可作為藥物載體用于治療疾病
C. 在反應①中環丙胺的作用可能是促進氯化鐵水解
D. 反應②的化學方程式是6FeOOH +CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了防止鋼鐵銹蝕,下列防護方法中正確的是( )
A.在精密機床的鐵床上安裝銅螺釘
B.在排放海水的鋼鐵閥門上用導線連接一塊石墨,一同浸入海水中
C.在海輪舷上用鐵絲系住鋅板浸在海水里
D.在地下輸油的鑄鐵管上接直流電源的正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是
A.0.1 mol·L1 K2CO3溶液:Na+、Ba2+、ClO 、OH
B.0.1 mol·L1 Al2(SO4)3溶液:Na+、NH4+ 、OH、Cl
C.0.1 mol·L1 HCl 溶液:Ba2+、K+、CH3COO、NO3
D.0.1 mol·L1 NaOH溶液:K+、Na+、SO42、CO32
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A.糖類、油脂和蛋白質均可發生水解反應
B.戊烷(C5H12)有兩種同分異構體
C.乙烯、聚氯乙烯和苯分子中均含有碳碳雙鍵
D.乙酸和乙酸乙酯可用Na2CO3溶液加以區別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究小組發現一種化合物在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如圖所示,計算反應4 min~8 min間的平均反應速率和推測反應16 min時反應物的濃度,結果應是( )

A. 2.5 μmol·L-1·min-1和2.0 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com