
(08上海嘉定區期末)某研究性學習小組擬用銅屑與氧化銅混合物與硫酸和硝酸組成的混酸反應來制取CuSO4?5H2O晶體,混酸中硝酸的還原產物為NO,反應過程中不產生SO2,反應后的溶液中不含Cu(NO3)2, 反應中固體完全溶解,兩種酸均恰好完全反應。設固體混合物的總質量為480 g,其中銅屑的質量分數為x,試回答下列問題:
(1)所得硫酸銅晶體的質量y為: g(用x表示);
(2)若x =0.4,混酸中HNO3與H2SO4的物質的量之比為: ;
(3)若x =0.4,480g固體混合物與一定量混酸微熱后,充分反應,冷卻恰好只得到CuSO4?5H2O,試求原混酸中H2SO4的質量分數(寫出計算過程)。
答案:
(1)1875x+1500-1500x=375x+1500(2分)
Cu――CuSO4?5H2O CuO--------- CuSO4?5H2O
64/480x 250/a 80/[480(1-x)] 250/b
y=a+b=(250×480x)/64+250×480(1-x)/80=1875x+1500-1500x=375x+1500
(2) 1∶3.3
當x=0.4 m(Cu) = 480×0.4=192g m(CuO)=480g-192g=288g
n(Cu) =192/64=3mol n(CuO) = 288/80=3.6mol
n(Cu) +n(CuO)=3mol +3.6mol = 6.6mol
由Cu守恒得: n(H2SO4)=n(CuSO4?5H2O)=6.6mol
設HNO3為xmol ,由得失電子數相同得: 2×480×0.4/64=3x x=2
n(HNO3):n(H2SO4)=2:6.6=1:3.30
(3) m(CuSO4?5H2O)=6.6mol×250g/mol=1650g
n(HNO3) =2mol 則放出NO為2mol,質量為2×30=60g
根據質量守恒:m(溶液)=1650+2×30-480=1230g
所以,H2SO4%=6.6×98/12300×100%=52.6%


 七彩題卡口算應用一點通系列答案
七彩題卡口算應用一點通系列答案科目:高中化學 來源: 題型:
2(08浙江省開化中學模擬)實驗室中根據2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1設計如下圖所示實驗裝置來制備SO3固體。請回答下列問題。
2SO3;ΔH=-393.2 kJ?mol-1設計如下圖所示實驗裝置來制備SO3固體。請回答下列問題。
 |
(1)實驗前,必須進行的操作是(填操作名稱,不必寫具體過程)
(2)在A裝置中加入Na2SO3固體的同時,還需加幾滴水,然后再滴加濃硫酸。加幾滴水的作用是
(3)小試管C的作用是
(4)廣口瓶D內盛的試劑是 。裝置D的三個作用是 ①
② ③
(5)實驗中當Cr2O3表面紅熱時,應將酒精燈移開一會兒再加熱,以防溫度過高,這樣做的原因是
(6)裝置F中U型管內收集到的物質的顏色、狀態是
(7)裝置G的作用是
(8)從G裝置導出的尾氣處理方法是
查看答案和解析>>
科目:高中化學 來源: 題型:
(08皖南8校第三次聯考)1 L某混合溶液,可能含有的離子如下表:
可能大量還有的陽離子 |
|
可能大量還有的陰離子 |
|
 (1)往該溶液中逐滴加入
(1)往該溶液中逐滴加入![]() 溶液并適當
溶液并適當
加熱,產生沉淀和氣體的物質的量(![]() )
)
與加入![]() 溶液的體積(V)的關系
溶液的體積(V)的關系
如右圖所示。則該溶液中確定含有的離子
有_______________;不能確定是否含有
的陽離子有______________,要確定其存
在可補充做的實驗是___________;肯定不存在的陰離子有_________________。
(2)經檢測,該溶液中含有大量的![]() ,若向1 L該混合溶液中通入―定暈的
,若向1 L該混合溶液中通入―定暈的![]() ,溶液中
,溶液中![]() 的物質的量與通入
的物質的量與通入![]() 的體積(標準狀況)的關系如下表所示,分析后回答下列問題:
的體積(標準狀況)的關系如下表所示,分析后回答下列問題:

查看答案和解析>>
科目:高中化學 來源: 題型:
 (08安徽信息卷)2008年北京奧運會體現“人文奧運”的一個重要舉措是堅決反對運動員服用興奮劑。利尿酸足一種被禁止使用的藥物,其結構簡式如圖所示。下列有關利尿酸說法正確的是()
(08安徽信息卷)2008年北京奧運會體現“人文奧運”的一個重要舉措是堅決反對運動員服用興奮劑。利尿酸足一種被禁止使用的藥物,其結構簡式如圖所示。下列有關利尿酸說法正確的是()
A.利尿酸衍生物利尿酸甲酯的分子式是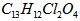
B.1mo1利尿酸最多能與4 mol![]() 發生加成反應
發生加成反應
C.利尿酸分子內處于同一平面上的原子數不少于12個
D.利尿酸能與 溶液發生顯色反應
溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源: 題型:
(08安徽信息卷)一種新型的乙醇電池(DEFC)用磺酸類質子溶劑,在200°C左右時供電,乙醇電池比甲醇電池效率高出32倍且更安全。電池總反應為: 。下列說法正確的是()
。下列說法正確的是()
 A.a極為電池的正極
A.a極為電池的正極
B.電池正極的電極反應為:
C.電池工作時電流由a極沿導線經燈泡再到b極
D.設每個電子所帶電量為q庫侖,則1mol乙醇被氧化產生6 厙侖的電量
厙侖的電量
查看答案和解析>>
科目:高中化學 來源: 題型:
(08安徽模擬)合肥某院校研究出的甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H2=-192.9KJ/mol
下列說法正確的是 ()
A.根據②推知:在25℃,101kPa時,lmolCH3OH (g)燃燒生成
CO2 和HZO(l)放出的熱量應大于192.9kJ
B.反應②中的能量變化如右圖所示,則△H2=E1一E3
C.H2燃燒能放出大量的熱,故CH30H轉變成H2的過程必須吸收能量
D.根據蓋斯定律,可以推出氫氣和氧氣反應生成1mol液態水的反應熱。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com