
| 物質 | X | Y | Z |
| 初始濃度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡濃度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反應達到平衡時,X的轉化率為60% | |
| B. | 在25℃時,反應可表示為X+3Y═2Z,其平衡常數為1600 | |
| C. | 增大壓強使平衡向生成Z的方向移動,平衡常數增大 | |
| D. | 升高溫度此反應的平衡常數增大 |
分析 A.根據轉化率=$\frac{濃度變化的量}{起始濃度}$×100%進行計算;
B.根據反應速率之比等于化學計量數之比判斷化學方程式,根據平衡常數表達式計算平衡常數;
C.依據化學方程式反應前后的氣體體積變化情況,結合平衡影響因素分析判斷;
D.沒有告訴該反應為吸熱反應還是放熱反應,無法判斷升高溫度后平衡移動方向.
解答 解:A.反應達到平衡時,X的轉化率為:$\frac{0.1mol/L-0.05mol/L}{0.1mol/L}$=50%,故A錯誤;
B.根據反應速率之比等于濃度變化量之比等于化學計量數之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,則反應的方程式為X(g)+3Y(g)?2Z(g),K═$\frac{0.{1}^{2}}{0.05×0.0{5}^{3}}$=1600,故B正確;
C.該反應的正反應是氣體體積減小的反應,增大壓強平衡向正反應方向移動,即向著生成Z的方向移動,但是溫度不變,平衡常數不變,故C錯誤;
D.該反應若是放熱反應,升高溫度后平衡向著逆向移動,平衡常數會減小,故D錯誤;
故選B.
點評 本題考查了化學平衡的計算,題目難度中等,明確化學平衡常數的概念及影響因素為解答關鍵,注意掌握化學平衡的特征及計算方法,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{2}^{3}$He原子核內有2個中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3個電子 | |
| C. | ${\;}_{2}^{3}$He原子核內有3個質子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是兩種不同的核素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
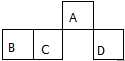 短周期元素A、B、C、D在元素周期表中的相對位置如圖.其中A原子的最外層電子數是最內層電子數的3倍.下列判斷正確的是( )
短周期元素A、B、C、D在元素周期表中的相對位置如圖.其中A原子的最外層電子數是最內層電子數的3倍.下列判斷正確的是( )| A. | 原子半徑:rD>rC>rB>rA | |
| B. | 含D元素的鹽溶液一定顯中性 | |
| C. | 氫化物的熱穩定性:C>D | |
| D. | D的單質能與A形成的氫化物反應生成具有漂白性的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
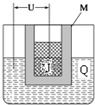
 某鈣鈦型復合氧化物(如圖),以A原子為晶胞的頂點,A位可以是Ca、Sr、Ba或Pb,當B位是V、Cr、Mn、Fe時,這種化合物的電阻率在有外磁場作用時較之無外磁場作用時存在巨大變化(巨磁電阻效應).
某鈣鈦型復合氧化物(如圖),以A原子為晶胞的頂點,A位可以是Ca、Sr、Ba或Pb,當B位是V、Cr、Mn、Fe時,這種化合物的電阻率在有外磁場作用時較之無外磁場作用時存在巨大變化(巨磁電阻效應).| 碳酸鹽 | CaCO3 | SrCO3 | BaCO3 |
| 熱分解溫度/℃ | 900 | 1172 | 1360 |
| 陽離子半徑/pm | 99 | 112 | 135 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣主要成分之一.請回答:
已知X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣主要成分之一.請回答: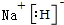
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1L0.1mol•L-1 CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 常溫下,將稀氨水逐滴加入到稀硫酸中,當溶液的pH=7時:c(NH4+)=2c(SO42-) | |
| D. | 等體積、等物質的量濃度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 其密度之比等于對應的物質的量之比 | |
| B. | 其質量之比等于相對分子質量之比 | |
| C. | 等質量的三種氣體,其體積比等于相對分子質量的倒數之比 | |
| D. | 等體積的三種氣體,其物質的量比等于相對分子質量之比 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com