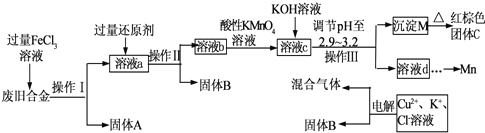
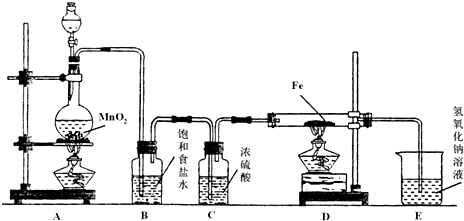
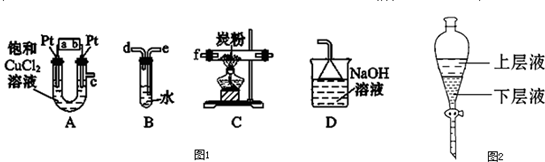
某研究性學習小組設計了一組實驗來探究元素周期律.甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖1裝置來一次性完成同主族元素碳與硅的非金屬性強弱比較的實驗研究;乙同學設計了如圖2裝置來驗證鹵族元素性質的遞變規律,A、B、C三處分別是沾有NaBr溶液的棉花、濕潤的淀粉KI試紙、濕潤的紅色試紙.已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣.
根據圖1回答:
(1)寫出選用物質的名稱:A
硝酸
硝酸
,B
碳酸鈣
碳酸鈣
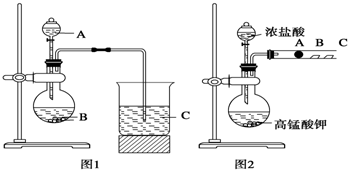
C
硅酸鈉溶液
硅酸鈉溶液
;
(2)燒瓶中反應的離子方程式為
CaCO3+2H+=Ca2++CO2+H2O
CaCO3+2H+=Ca2++CO2+H2O
;
燒杯中反應的離子方程式為
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2過量)
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2過量)
;
根據圖2回答:
(3)乙同學的實驗原理是
強氧化劑生成弱氧化劑或活潑的非金屬單質置換出較不活潑的非金屬單質
強氧化劑生成弱氧化劑或活潑的非金屬單質置換出較不活潑的非金屬單質
;
(4)B處的實驗現象是
濕潤的淀粉KI試紙變藍
濕潤的淀粉KI試紙變藍
;
(5)B處的反應的離子方程式:
2I-+Cl2?I2+2Cl-
2I-+Cl2?I2+2Cl-
.