
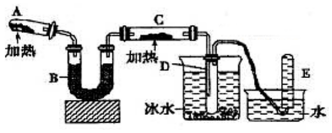
 己知氨可以與灼熱的氧化銅反應得到氮氣和金屬銅,用示意圖中的裝置可以實現該反應.
己知氨可以與灼熱的氧化銅反應得到氮氣和金屬銅,用示意圖中的裝置可以實現該反應.分析 (1)氯化銨與氫氧化鈣在加熱的條件下反應生成氯化鈣、水和氨氣;
(2)氨氣為堿性氣體,應選擇堿性干燥劑;
(3)氨氣語言銅發生氧化還原反應,將氧化銅還原為銅;無水硫酸銅與水反應生成藍色的五水硫酸銅;
(4)氨氣和氧化銅在加熱的條件下發生反應生成金屬銅、水以及氮氣;反應總氨氣中-3價的氮化合價升高氮氣中的0價,生成1mol氮氣,失去6mol電子.
解答 解:(1)依據題中生成氨氣的反應原理可知,氯化銨與氫氧化鈣在加熱的條件下反應生成氯化鈣、水和氨氣,化學方程式為:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案為:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨氣能夠與濃硫酸、氯化鈣反應,不能用濃硫酸、氯化鈣干燥,氨氣為堿性氣體,應選擇堿性干燥劑,堿石灰為堿性干燥劑,可以干燥氨氣;
故答案為:③;
(3)氨氣和氧化銅在加熱的條件下發生反應生成金屬銅、水以及氮氣,反應現象是:黑色粉末逐漸變為紅色;白色的無水硫酸銅與水反應生成藍色的五水硫酸銅,通常用無水硫酸銅檢驗水的存在;
故答案為:黑色粉末逐漸變為紅色;白色固體變藍;
(4)氨氣和氧化銅在加熱的條件下發生反應生成金屬銅、水以及氮氣,方程式:2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,反應總氨氣中-3價的氮化合價升高氮氣中的0價,生成1mol氮氣,失去6mol電子;
故答案為:2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu;6mol.
點評 本題考查學生氨氣的實驗室制法、干燥以及氨氣的還原性方面的知識,結合實驗來考查,增加了難度.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下硫的氧化物都是氣體,通入水中都形成強酸 | |
| B. | 將FeCl3滴入飽和H2S溶液中,溶液的pH降低 | |
| C. | 將CO2通入CaSO4溶液中,無明顯現象 | |
| D. | 充分利用含硫礦物,既可實現資源的有效利用,還可減輕酸雨污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
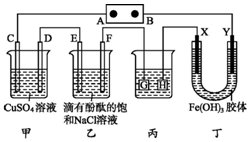 如圖裝置所示,C、D、E、F、X、Y都是惰性電極,甲、乙中溶液的體積和濃度都相同(假設通電前后溶液體積不變),A、B為外接直流電源的兩極.將直流電源接通后,F極附近呈紅色.
如圖裝置所示,C、D、E、F、X、Y都是惰性電極,甲、乙中溶液的體積和濃度都相同(假設通電前后溶液體積不變),A、B為外接直流電源的兩極.將直流電源接通后,F極附近呈紅色.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠礬一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明礬一Al(SO4)3•12H2O | D. | 膽礬一CuSO4•5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應①中電能轉化為化學能 | |
| B. | 反應②使用催化劑,△H2減小 | |
| C. | 反應③中反應物的總能量高于生成物的總能量 | |
| D. | 反應CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com