
大氣污染物根據組成成分,可分為_________、_________( )、_________( )、_________、_________,以及_________(常用作_________,商品名為_________) 等。
等。
科目:高中化學 來源:2015-2016學年山東省平度市高二上學期直升班抽考化學試卷(解析版) 題型:實驗題
某化學小組為比較鹽酸和醋酸的酸性,設計了如下實驗方案。裝置如圖(夾持儀器略):
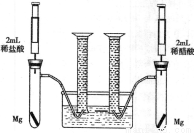
實驗方案:在兩試管中分別加入過量鎂條,同時將兩注射器中的溶液注入相應試管中,觀察產生氫氣的速率和體積。
(1)鹽酸與鎂反應的離子方程式為____________________。
(2)在上述實驗方案中有一明顯欠缺,該欠缺是____________。
(3)在欠缺已經得到改正的方案下,反應起始時,產生氫氣的速率關系應是____________;最終產生氫氣體積的關系應是_______________。
(4)實驗中產生的氫氣體積比理論值高,可能原因是_______________________。
(5)通過比較起始反應的速率可以得出的結論是______________。
(6)除上述方法外,還可以通過其他方向比較鹽酸和醋酸的酸性,請寫出其中的一種方法_________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二上學期12月月考化學試卷(解析版) 題型:選擇題
某烯烴與H2加成后的產物是 , 則該烯烴的結構式可能有( )
, 則該烯烴的結構式可能有( )
A.1種 B.2種 C.3種 D.4種
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高二上學期第三次月考化學試卷(解析版) 題型:選擇題
某有機化合物的結構簡式如下:
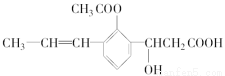 此有機化合物屬于( )
此有機化合物屬于( )
①烯烴 ②多官能團有機化合物 ③芳香烴 ④烴的衍生物 ⑤高分子化合物
A.①②③④ B.②④ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化學 來源:2016屆江西師大附中、臨川一中高三上第一次聯考化學試卷(解析版) 題型:推斷題
下表為元素周期表的一部分,請參照元素①-⑩在表中的位置,回答下列問題:
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)自然界物質種類最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的離子半徑由大到小的順序為 (填化學用語)。
(3)寫出由⑥、⑧、⑩元素形成的一種離子化合物的電子式_____________________
(4)②的最高價氧化物對應的水化物與鹽酸反應的離子方程式____________________
(5)根據斜線性質相似規則,③的氧化物,氫氧化物有兩性,寫出③的單質與⑧的最高價氧化物的水化物反應的化學方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分別是由①⑤⑥三種元素形成的四種十電子粒子,
寫出該反應式__________________________
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣西欽州港經濟開發區中學高二上12月月考化學試卷(解析版) 題型:選擇題
下列物質不屬于“城市空氣質量日報”報道的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.懸浮顆粒
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北大名縣一中高一上學期第二次月考化學試卷(解析版) 題型:實驗題
應用下列裝置,在硬質破璃管中放入還原鐵粉和石棉絨的混合物加熱,并通過水蒸氣,就可以完成“高溫下Fe與水蒸氣的反應實驗”。
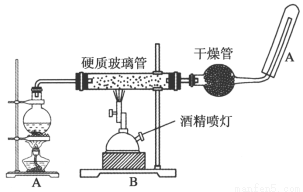
請完成該實驗中的問題:
(1)寫出該反應的化學方程式: ;該氧化還原反應的氧化劑是 。
(2)實驗前必須對整套裝置進行的操作是 。
(3)圓底燒瓶中盛裝的是水,該裝置受熱后的主要作用是 ;燒瓶底部放置了幾片碎瓷片,碎瓷片的作用是 。
(4)檢驗溶液中是否含有三價鐵離子用 溶液(寫化學式),現象是 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二上學期期中考試化學試卷(解析版) 題型:選擇題
已知某溫度下CH3COOH和NH3·H2O的電離常數相等,現向10 mL濃度為0.1 mol/L的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中( )
A.水的電離程度始終增大
B.c(NH4+)/c(NH3·H2O)先增大再減小
C.c(CH3COOH)與c(CH3COO-)之和始終保持不變
D.當加入氨水的體積為10 mL時,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源:2016屆西藏自治區拉薩中學高三上學期第四次月考化學試卷(解析版) 題型:填空題
為了保護壞境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦燒渣(Fe主要以Fe2O3存在)轉變成重要的化工原料FeSO4(反應條件略)。
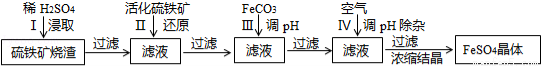
活化硫鐵礦還原Fe3+的主要反應為:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考慮其它反應,請回答下列問題:
(1)第Ⅰ步H2SO4與Fe2O3反應的離子方程式是 。
(2)檢驗第Ⅱ步中Fe3+是否完全被還原,應選擇 (填字母編號)。
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3調溶液pH到5.8左右,然后在第Ⅳ步通入空氣使溶液pH到5.2,此時Fe2+不沉淀,濾液中鋁、硅雜質被除盡,通入空氣引起溶液pH降低的原因是 。
(4)FeSO4可轉化為FeCO3,FeCO3在空氣中加熱反應可制得鐵系氧化物材料。
已知25℃,101kPa時:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是 。
(5)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料,該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+FeS2=Fe+2Li2S,正極反應式是 。
(6)假如燒渣中的鐵全部視為Fe2O3,其含量為50%,將a kg質量分數為b%的硫酸加入到c kg燒渣中浸取,鐵的浸取率為96%,其它雜質浸出消耗的硫酸以及調pH后溶液呈微酸性,所殘留的硫酸忽略不計,按上述流程,第Ⅲ步應加入FeCO3 kg
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com