
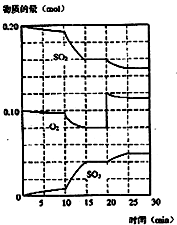
 某溫度時,在一個2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間的變化曲線如圖所示.根據圖中數據,試填寫下列空白:
某溫度時,在一個2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間的變化曲線如圖所示.根據圖中數據,試填寫下列空白:| △c |
| △t |
| n |
| V |
 2Z,
2Z, 2Z;
2Z;
| ||
| 2min |
| n |
| V |
| 0.7mol |
| 2L |


科目:高中化學 來源: 題型:
| A、1個N2分解的同時,有3個H2的形成 |
| B、1個N2分解的同時,有3個H2的分解 |
| C、1個N2分解的同時,有1個NH3的分解 |
| D、1個N2分解的同時,有2個NH3的形成 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、常溫下,Al與濃硫酸接觸無明顯現象,是由于Al與濃硫酸不反應 |
| B、SO2水溶液和氯水均具有漂白性,兩者混合漂白性將增強 |
| C、已知相同溫度下Ksp(BaSO4)<Ksp(BaCO3),故BaSO4無法轉化為BaCO3 |
| D、CO2氣體通入Na2SiO3溶液中產生白色沉淀,可說明碳元素的非金屬性比硅元素強 |
查看答案和解析>>
科目:高中化學 來源: 題型:
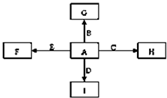 圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的
圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的| 高溫 |
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
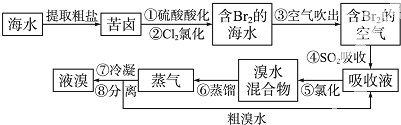
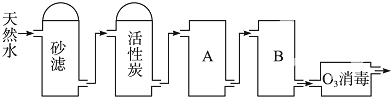
查看答案和解析>>
科目:高中化學 來源: 題型:
 (1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示| 體系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反應方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 |
查看答案和解析>>
科目:高中化學 來源: 題型:
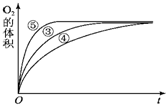
查看答案和解析>>
科目:高中化學 來源: 題型:
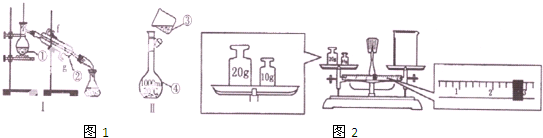
 某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.
某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL 2% H2O2溶液 | 無 |
| ② | 10mL 5% H2O2溶液 | 無 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com