
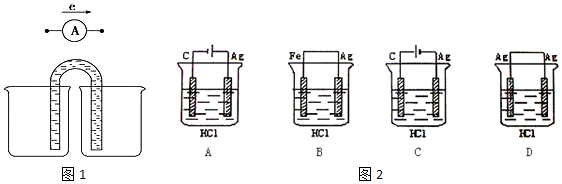
分析 (1)能設計成原電池的反應必須是自發進行的放熱的氧化還原反應;
(2)將2FeCl3+Fe═3FeCl2設計成原電池反應,則Fe為負極,正極可為碳棒等,負極電解質溶液為FeCl2,正極電解質溶液為FeCl3;
(3)鹽酸和銀不能自發的進行氧化還原反應,所以不能設計成原電池,只能設計成電解池,失電子的物質作電解池陽極,金屬或導電的非金屬作電解池陰極,失電子的物質作電解質溶液,據此分析解答.
解答 解:(1)能設計成原電池的反應應是能自發進行的氧化還原反應,①為氧化還原反應,且反應放熱,可設計成原電池,②為吸熱反應,③為中和反應,沒有電子的轉移,不能設計成原電池,故答案為:①;
(2)由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,為原電池的負極,負極反應為Fe-2e-=Fe2+,正極Fe3+被還原,電極方程式為2Fe3++2e-=2Fe2+,負極電解質溶液為FeCl2,正極電解質溶液為FeCl3,原電池工作時,陰離子向負極移動,裝置圖為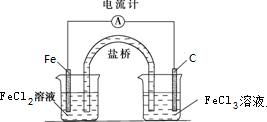 ,
,
故答案為: ;2Fe3++2e-=2Fe2+;負極;
;2Fe3++2e-=2Fe2+;負極;
(3)①2HCl+2Ag=2AgCl↓+H2↑不能自發進行,所以必須設計成電解池,該反應中銀失電子,所以銀作電解池陽極,金屬或導電的非金屬作電解池陰極,該反應中氯化氫得電子生成氫氣,則選取鹽酸作電解質溶液,所以A選項符合條件,
故選A;
②根據所選的裝置,銀作電解池陽極,電極反應式:Cl-+Ag-e-=AgCl↓,由總反應2HCl+2Ag=2AgCl↓+H2↑,則反應一段時間后,消耗HCl,則溶液的pH變化是變大,故答案為:Cl-+Ag-e-=AgCl↓;A;
③由Cl-+Ag-e-=AgCl↓,若有1.08g Ag被消耗,該原電池轉移的電子數目是$\frac{1.08g}{108g/mol}$×1=0.01mol,
故答案為:0.01mol.
點評 本題考查原電池、電解池的設計,側重于學生的分析能力和電化學知識的綜合考查,為高考常見題型和高頻考點,難度不大,明確原電池的構成條件及反應必須是放熱反應是解本題的關鍵.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:選擇題
| A. | 12倍 | B. | 24倍 | C. | 48倍 | D. | 96倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
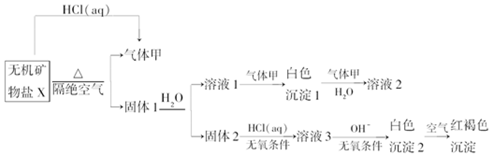
 ,寫出氣體甲的電子式
,寫出氣體甲的電子式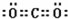 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

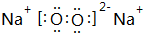 ;
;查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高一上10月月考化學試卷(解析版) 題型:選擇題
下列物質中,本身屬于非電解質,溶于水與水反應的生成物屬于電解質的是 ( )
A.氯化鈉 B.氯氣 C.三氧化硫 D.乙醇
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com