
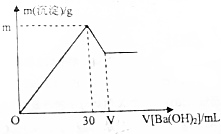
 現有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物質的量濃度的Ba(OH)2溶液,產生沉淀的質量與加入Ba(OH)2溶液體積的關系如圖所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)
現有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物質的量濃度的Ba(OH)2溶液,產生沉淀的質量與加入Ba(OH)2溶液體積的關系如圖所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)分析 (1)由于是向10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物質的量濃度的Ba(OH)2溶液,故開始Al3+轉變為Al(OH)3沉淀,故化學方程式為:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓.根據反應可知,Al3+和SO42-能同時沉淀完全,從而得沉淀的最大量,故加入氫氧化鋇溶液30mL時,Al2(SO4)3和Ba(OH)2的物質的量之比為1:3,據此求出所需的氫氧化鋇的物質的量和物質的量濃度;
(2)m的值即Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反應生成Al(OH)3和BaSO4沉淀的質量;
30mL-VmL氫氧化鋇溶液的作用是將生成的氫氧化鋁沉淀溶解,故根據氫氧化鋁的物質的量即可求出氫氧化鋇的物質的量,從而求出V的值.
解答 解:(1)由于是向10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物質的量濃度的Ba(OH)2溶液,故開始Al3+轉變為Al(OH)3沉淀,故化學方程式為:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓.根據反應可知,Al3+和SO42-能同時沉淀完全,從而得沉淀的最大量.Al2(SO4)3的物質的量n=CV=1mol/L×0.01L=0.01mol,設當得到沉淀的最大量時,氫氧化鋇的物質的量為xmol,
則有:Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓
1 3
0.01mol xmol
故有:$\frac{1}{0.01mol}=\frac{3}{xmol}$
解得x=0.03mol
由于氫氧化鋇體積為30mL,故氫氧化鋇的物質的量濃度c=$\frac{0.03mol}{0.03L}$=1mol/L.
答:氫氧化鋇溶液的濃度為1mol/L.
(2)m的值即Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反應生成Al(OH)3和BaSO4沉淀的質量,設Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反應生成Al(OH)3和BaSO4沉淀時,生成的Al(OH)3和BaSO4沉淀的物質的量分別為ymol和Zmol,則有:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓
1 2 3
0.01mol ymol zmol
故有:$\frac{1}{0.01mol}=\frac{2}{ymol}=\frac{3}{zmol}$
解得y=0.02mol
z=0.03mol
故沉淀的質量m=0.02mol×78g/mol+0.03mol×233g/mol=8.55g;
30mL至VmL氫氧化鋇溶液的作用是將生成的氫氧化鋁沉淀溶解,由于氫氧化鋁的物質的量為0.02mol,設消耗的氫氧化鋇的物質的量為Qmol,根據反應可知:
Al(OH)3+OH-=AlO2-+2H2O
1 1
0.02mol 2Qmol
故有:$\frac{1}{0.02mol}=\frac{1}{2Qmol}$
解得Q=0.01mol
故所需的氫氧化鋇的體積VmL-30mL=$\frac{n}{C}$=$\frac{0.01mol}{1mol/L}$=0.01L=10mL
故V=40mL.
答:m的值為8.55g,V的值為40mL.
點評 本題考查了根據圖象和化學方程式進行的有關計算,難度中等,應注意的是由于是將氫氧化鋇向硫酸鋁溶液中滴加,故鋁離子先轉化為氫氧化鋁沉淀,后溶解.


科目:高中化學 來源: 題型:推斷題
 ,B 同周期第一電離能最小的主族元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題:
,B 同周期第一電離能最小的主族元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題: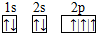 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 甲腎上腺素的分子式為:C8H10NO3 | |
| B. | 1 mol去甲腎上腺素最多能與2 mol Na發生反應 | |
| C. | 1 mol去甲腎上腺素最多能與2 mol Br2發生取代反應 | |
| D. | 去甲腎上腺素能發生加成、取代、消去和氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 名稱為:2,5-二甲基-2,4-己二烯
名稱為:2,5-二甲基-2,4-己二烯 名稱為:2,4-二甲基-3-乙基戊烷.
名稱為:2,4-二甲基-3-乙基戊烷.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
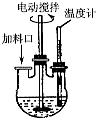 實驗室制取高純NaI晶體(無色)可按下列步驟進行:按化學計量稱取各原料,在三頸燒瓶中(如圖)先加入適量的高純水,然后按Na2CO3、I2和水合肼的投料順序分批加入.
實驗室制取高純NaI晶體(無色)可按下列步驟進行:按化學計量稱取各原料,在三頸燒瓶中(如圖)先加入適量的高純水,然后按Na2CO3、I2和水合肼的投料順序分批加入.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com