
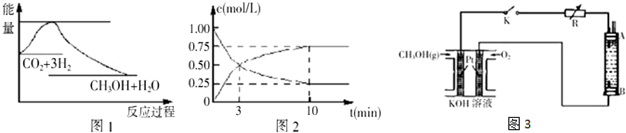
分析 (1)25℃,1.01×105Pa時,16g 液態甲醇完全燃燒,當恢復到原狀態時,放出363.3kJ的熱量,依據書寫熱化學方程式的方法寫出該反應的熱化學方程式;
(2)①根據反應速率v=$\frac{△c}{△t}$計算反應速率,轉化率等于變化濃度和初始濃度的比值;
②相同條件下達到平衡時,混合物中各組分的物質的量與(1)中平衡相同,說明兩平衡為完全等效平衡,(1)中轉化率比(2)中的高,參加反應的氮氣的物質的量較(2)多;
③能使H2的轉化率提高的措施是促使化學平衡正向移動的措施,但是不能增加氫氣的投料;
(3)燃料電池是原電電池裝置,通入燃料CH3OH是負極,發生氧化反應,通入氧氣的電極是正極,該電極上發生得電子的還原反應,電解法制取Fe(OH)2的陽極材料是金屬鐵,該電極上金屬鐵失電子發生氧化反應,在陰極上發生的反應是2H++2e-=H2↑,在陰極附近可以產生氫氧化亞鐵沉淀,根據電極反應式進行計算.
解答 解:(1)25℃,1.01×105Pa時,16g 液態甲醇物質的量為0.5mol,完全燃燒,當恢復到原狀態時,放出363.3kJ的熱量,依據書寫熱化學方程式的方法寫出該反應的熱化學方程式為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1.
(2)①在體積為lL的密閉容器中充入lmolCO2和4molH2,一定條件下發生反應:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
初始濃度:1 4 0 0
變化濃度:0.75 2.25 0.75 0.75
平衡濃度:0.25 1.75 0.75 0.75
從反應開始到平衡,CH3OH的平均反應速率v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min);H2的轉化率為$\frac{2.25}{4}$×100%=56.25%,故答案為:0.075mol/(L•min));56.25%;
②相同條件下達到平衡時,混合物中各組分的物質的量與(1)中平衡相同,說明兩平衡為完全等效平衡,平衡時氨氣的物質的量相同,由于(2)中起始含有cmol NH3,故(2)中反應生成的氨氣比(1)少,(1)中參加反應的氮氣的物質的量較(2)多,所以放出的熱量(1)>(2).
故答案為:大于;
③A.反應是放熱的,升高溫度,平衡逆向移動,所以氫氣的轉化率減小,故錯誤;
B.將CH3OH(g)及時液化抽出,平衡正向移動,所以氫氣的轉化率增大,故正確;
C.選擇高效催化劑,能加快反應速率,但是不會引起化學平衡的移動,轉化率不變,故錯誤;
D.相同條件下 再充入lmolCO2和4molH2相當于對平衡加壓,所以反應物的轉化率增加,故正確,故選BD;
(3)①燃料電池是原電電池裝置,通入燃料CH3OH是負極,發生氧化反應,電極反應為:CH3OH+8OH--6e-=CO32-+6H2O;故答案為:CH3OH+8OH--6e-=CO32-+6H2O;
②A.電源中的負極附近發生反應:CH3OH+8OH--6e-=CO32-+6H2O,pH降低,故錯誤;
B.電極B和電源正極相連,是陽極,該電極上發生氧化反應,故正確;
C.電解法制取Fe(OH)2的陽極B材料是金屬鐵,該電極上金屬鐵失電子發生氧化反應,但是A電極不一定用金屬鐵,故錯誤;
D.陰極發生的反應是還原反應:2H++2e-=H2↑,該電極附近氫氧根離子濃度增加,產生氫氧化亞鐵,故正確;
E.電解的電解質溶液不能是CuSO4溶液,這樣的話在陰極上產生金屬銅,發生的反應是金屬鐵置換銅的反應,不能得到氫氧化亞鐵,故錯誤;
故選BD;
③若電池中甲醇的通入量為8g,且反應完全,根據負極反應:CH3OH+8OH--6e-=CO32-+6H2O,轉移電子的物質的量是$\frac{8g}{32g/mol}$×6=1.5mol,根據Fe~2e-~Fe(OH)2,則理論上最多能產生Fe(OH)2沉淀質量:$\frac{1.5mol}{2}$×90g/mol=67.5g,故答案為:67.5.
點評 本題考查綜合考查電極反應式的書寫、計算、蓋斯定律的應用和熱化學方程式的書寫、速率和平衡的計算等知識,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微量元素缺少或者攝入過多,都可能導致患各種代謝疾病 | |
| B. | 兒童缺鋅可導致生長發育不良,抵抗力差,食欲不振 | |
| C. | 人體缺鈣,可以多喝硬水補鈣 | |
| D. | 缺鐵性貧血,可通過食用鐵強化醬油預防 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/K | 298 | 398 | 498 | … |
| 平衡常數(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在水中加入少量ZnSO4固體時,水的電離平衡向正反應方向移動,Kw減小 | |
| B. | 在ZnSO4溶液中各離子的濃度關系為:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等體積的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常溫下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要調節pH≥8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉、纖維素、蔗糖和麥芽糖水解的最終產物都是葡萄糖 | |
| B. | 可以用Na2CO3溶液或者NaOH溶液除去乙酸乙酯中的乙酸和乙醇 | |
| C. | 天然油脂是混合物,主要成分是飽和和不飽和的高級脂肪酸 | |
| D. | 蛋白質溶液中加入Na2SO4可使其析出,再加水蛋白質又會重新溶解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com