
甲醇是重要的化工原料,在日常生活中有著廣泛的應用。
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反應Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制備甲醇的兩個反應中:反應Ⅰ優于反應Ⅱ,原因為_________________。
②對于反應Ⅰ,下圖甲表示能量的變化;圖乙表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時聞巒化。

在“圖甲”中,曲線__________(填:“a”或“b”)表示使用了催化劑;該反應屬于________(填:“吸熱”、“放熱”)反應。在圖乙中從反應開始到建立平衡,用H2濃度變化表示的反應速率為_____________;該溫度下CO(g)+2H2(g) CH3OH(g)的化學平衡常數為__________.
CH3OH(g)的化學平衡常數為__________.
③對于反應Ⅱ,在一定溫度時,將lmol CO2年和3mol H2充入一密閉恒容容器中,充分反應達到平衡后,若CO2的轉化率為a,則容器內的平衡壓強與起始壓強之比為__________;若容器容積不變,下列措施可增加甲醇產率的是____________。
a.升高溫度
b.增加CO2的量
c.充入He,使體系總壓強增大
d.按原比例再充入CO2和H2
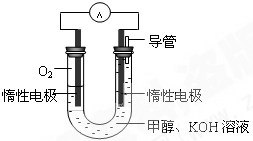
(2)甲醇對水質會造成一定的污染,有一種電化學法可消除這種 污染,其原理是:通電后,將Co2+氧化成Co3+,然后以Co3+做氧化劑把水中的甲醇氧化成CO2而凈化。實驗室用下圖裝置模擬上述過程。

①陽極電極反應式為____________。
②除去甲醇的離子方程式為________________。
(14分)(1)①反應I符合“原子經濟性”的原則即原子利用率為100%(1分)
②b(1分) 放熱(1分) 0.15mol/(L·min)(2分) 12(1分)③1- (2分) bd(2分)
(2分) bd(2分)
(2)①CO2+-e-=CO3+(2分)
②6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+(2分)
【解析】
試題分析:(1)①根據反應I和反應Ⅱ的生成物可知,反應I中生成物只有一種,而反應Ⅱ中還有水生成,即反應I符合“原子經濟性”的原則即原子利用率為100%,所以反應Ⅰ優于反應Ⅱ。
②根據圖像甲可知,曲線b的活化能低于曲線a的活化能,所以曲線b表示使用了催化劑;同樣根據圖像甲可知,反應物的總能量高于生成物的總能量,所以反應是放熱反應;根據圖像乙可知,反應進行到10min是反應達到平衡狀態,此時生成的甲醇濃度是0.75mol/L,則根據反應I可知,消耗氫氣的濃度是1.5mol/L,所以氫氣表示的反應速率是1.5mol/L÷10min=0.15mol/(L·min);平衡時氫氣的濃度是2mol/L-1.5mol/L=0.5mol/L,所以根據CO和甲醇的平衡濃度可知,該溫度下反應的平衡常數K= =12。
=12。
③
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
轉化量(mol/L) a 3a a a
平衡量(mol/L) 1-a 3-3a a a
則根據壓強之比是相應的物質的量之比可知
容器內的平衡壓強與起始壓強之比為 =1-
=1-
a.因正反應放熱,升高溫度可使平衡向逆反應方向移動,不能增加甲醇產率,故a不正確;
b.增加CO2的量,平衡向正反應方向移動,所以可以增加甲醇產率,故b正確;
c.充入He,使體系總壓強增大,對于參加反應的物質來說,濃度不變,平衡不移動,甲醇產率不變,故c錯誤;
d.按原比例再充入CO2和H2壓強增大,平衡向正反應方向移動,可以增加甲醇產率,故d正確。
答案選bd。
(2)①原電池中陽極失去電子,所以根據裝置圖可知,CO2+在陽極失去電子,陽極電極反應式為CO2+-e-=CO3+。
②Co3+做氧化劑,能把水中的甲醇氧化成CO2而凈化,反應的離子方程式是6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+。
考點:考查綠色化學、反應熱的判斷、反應速率和平衡常數的計算、外界條件對平衡狀態的影響、電解池的有關應用和電極反應式的書寫


科目:高中化學 來源: 題型:閱讀理解
 甲醇是重要的化工原料,在日常生活中有著廣泛的應用.
甲醇是重要的化工原料,在日常生活中有著廣泛的應用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源:2014屆云南省昆明市高三上學期第一次摸底調研測試化學試卷(解析版) 題型:填空題
甲醇是重要的化工原料和清潔液體燃料。工業上可利用CO或CO2來生產甲醇。甲醇制
備的相關信息如下表:

(1)反應②是____反應(選填“吸熱”“放熱”)。
(2)據上表信息推導出 、
、 與
與 之間的關系,
之間的關系, =______用
=______用 、
、 表示)。500℃時測得反應③在某時刻,
表示)。500℃時測得反應③在某時刻, 的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時
的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時 (選填“>”“<”“=”)。
(選填“>”“<”“=”)。
(3)若某溫度下反應①從開始到平衡CO和CH3OH的濃度變化如圖一所示,則用H2濃度變化表示此段時間內該反應的平均速.v(H2)=
若某溫度下反應①中H2的平衡轉化率(a)與體系總壓強(P)的關系如圖二所示,則平衡狀態由A變到B時,平衡常數 (選填“>”“<”“=”)。
(選填“>”“<”“=”)。

(4)一定溫度下,在體積固定的密閉容器中發生反應②,可判斷該反應已經達到平衡的是____。(用相應字母表示)
A.容器中總壓強不變
B.混臺氣體的平均摩爾質量也始終保持不變,
C.混合氣體的密度不變
D.CO2(g)或CO(g)的濃度不變
(5)一定條件下甲醇與一氧化碳反應可合成醋酸。室溫下,將a mol/L醋酸溶液與bmol/LNaOH溶液等體積混合。若溶液顯中性,則a_________b(選填“>”“<”“=”)。若c(Na+)<c(CH3COO-),則溶液顯____性(選填“酸”“堿…中”)。
查看答案和解析>>
科目:高中化學 來源:寧夏自治區模擬題 題型:填空題
 CH3OH(g) △H1
CH3OH(g) △H1  CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2 

查看答案和解析>>
科目:高中化學 來源:2011年寧夏銀川一中高考化學三模試卷(解析版) 題型:解答題
 CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com