
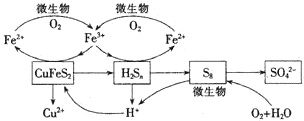
 我國產銅主要取自黃銅礦(CuFeS2),隨著礦石品味的降低和環保要求的提高,濕法煉銅的優勢日益突出.該工藝的核心是黃銅礦的浸出,目前主要有氧化浸出、配位浸出和生物浸出三種方法.
我國產銅主要取自黃銅礦(CuFeS2),隨著礦石品味的降低和環保要求的提高,濕法煉銅的優勢日益突出.該工藝的核心是黃銅礦的浸出,目前主要有氧化浸出、配位浸出和生物浸出三種方法.分析 Ⅰ、(1)①雙氧水將黃銅礦(CuFeS2)氧化得到硫酸根和三價鐵;
②H2O2受熱分解,Cu2+、Fe3+是H2O2分解的催化劑;
(2)增大一種反應物的濃度,可提高另一種反應物的轉化率;
(3)根據Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$計算;銨根離子的水解促進水的電離;
(4)由圖知Fe2(SO4)3、H2SO4是中間產物;在微生物作用下,氧氣把亞鐵離子氧化為鐵離子;
(5)鐵元素最終全部轉化為Fe3+,硫元素轉化為硫酸根,根據得失電子守恒計算.
解答 解:(1)①雙氧水將黃銅礦氧化得到硫酸根和三價鐵,離子方程式為:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
故答案為:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②H2O2受熱易分解,產物Cu2+、Fe3+催化H2O2分解;
故答案為:H2O2受熱分解,產物Cu2+、Fe3+催化H2O2分解等;
(2)增大一種反應物的濃度,可提高另一種反應物的轉化率,可提高氨水的濃度、提高氧壓;
故答案為:提高氨水的濃度、提高氧壓;
(3)在25℃下,氨水微弱電離,濃度約為0.5a,根據電荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,則c(NH4+)=c(Cl-)=0.01mol/L,NH3•H2O的電離常數Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3•}{H}_{2}O)}$=$\frac{1{0}^{-7}×0.01}{0.5a}$=$\frac{2×1{0}^{-9}}{a}$;銨根水解能與氫氧根結合,促進水的電離;
故答案為:$\frac{2×1{0}^{-9}}{a}$;正向;
(4)由圖知Fe2(SO4)3、H2SO4是中間產物,可循環使用,離子反應方程式為4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O;
故答案為:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O或S8+12O2+8H2O$\frac{\underline{\;微生物\;}}{\;}$8SO42-+16H+;
(5)鐵元素最終全部轉化為Fe3+,硫元素轉化為硫酸根,當有2mol SO42-生成時,失去電子工17mol,消耗O2的物質的量為$\frac{17}{4}$=4.25mol;
故答案為:4.25 mol.
點評 本題考查物質的分離提純、電離常數的計算以及氧化還原反應的計算等知識,側重考查基本理論及計算能力,明確反應原理、物質性質及離子方程式書寫規則是解本題關鍵,題目難度中等,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | Cu(OH)2和鹽酸; Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4; Ba(OH)2和CuSO4 | |
| C. | NaHCO3和NaHSO4 Na2CO3和NaHSO4 | |
| D. | NaHCO3( 過量)和Ca(OH)2 Ca(HCO3)2 和NaOH( 過量) |
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:填空題
工業上利用電鍍污泥(主要含有Fe2O3、CuO、Cr2O3及部分難溶雜質)回收銅和鉻等金屬,回收流程如下:

已知部分物質沉淀的pH及CaSO4的溶解度曲線如下:

(1)在浸出過程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要還有 。
(2)在除鐵操作中,需要除去Fe3+和CaSO4,請完成相關操作:
①加入石灰乳調節pH范圍 ,檢驗Fe3+已經除盡的操作是 ;
②將濁液加熱到80℃, 。
(3)寫出還原步驟中加入NaHSO3生成Cu2O固體反應的離子方程式: ,此步驟中加入NaHSO3得到Cu2O的產率為95%,若NaHSO3過量,除了浪費試劑外,還會出現的問題是 。
(4)當離子濃度小于或等于1×10-5 mol·L-1時可認為沉淀完全,若要使Cr3+完全沉淀則要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31, ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化學 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:填空題
【化學—選修3:物質結構與性質】人類在使用金屬的歷史進程中,經歷了銅、鐵、鋁之后,第四種將被廣泛應用的金屬被科學家預測是鈦(Ti),它被譽為“未來世紀的金屬”.試回答下列問題:

(1)Ti元素原子序數為22,它在元素周期表中的位置是第 周期第 族;其基態原子的電子排布式為 。
(2)在Ti的化合物中,可以呈現+2、+3、+4三種化合價,其中以+4價的Ti最為穩定.偏鈦酸鋇的熱穩定性好,介電常數高,在小型變壓器、話筒和擴音器中都有應用.偏鈦酸鋇晶體中晶胞的結構示意圖如圖1所示,它的化學式是 ,其中Ti4+的氧配位數為 ,Ba2+的氧配位數為 。
(3)常溫下的TiCl4是有刺激性臭味的無色透明液體,熔點﹣23.2℃,沸點136.2℃,所以TiCl4應是
化合物,其固體是 晶體。TiCl4在潮濕空氣中易揮發,水解而冒白煙,這是因為水解后有 生成。
(4)已知Ti3+可形成配位數為6的配合物,其空間構型為正八面體,如圖2所示,我們通常可以用圖3所示的方法來表示其空間構型(其中A表示配體,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空間構型也為八面體型,它有 種同分異構體,請將其結構畫出_________________。
查看答案和解析>>
科目:高中化學 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:選擇題
下列物質的制備與工業生產相符的是
①NH3  NO
NO 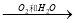 HNO3
HNO3
②濃HCl 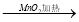 Cl2
Cl2  漂白粉
漂白粉
③MgCl2(aq) 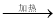 無水MgCl2
無水MgCl2  Mg
Mg
④飽和NaCl(aq) 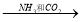 NaHCO3
NaHCO3 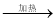 Na2CO3
Na2CO3
⑤鋁土礦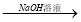 NaAlO2溶液
NaAlO2溶液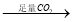 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二甲醚(CH3OCH3)是一種應用前景廣闊的清潔燃料,以CO和H2為原料生產二甲醚主要發生以下三個反應:
二甲醚(CH3OCH3)是一種應用前景廣闊的清潔燃料,以CO和H2為原料生產二甲醚主要發生以下三個反應:| 編號 | 熱化學方程式 | 化學平衡常數 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化學鍵 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 纖維素、蛋白質、油脂都是高分子化合物 | |
| B. | 糖類、蛋白質、油脂都是由C、H、O三種元素組成的 | |
| C. | 油脂有油和脂肪之分,但都屬于酯 | |
| D. | 只用淀粉溶液就可鑒別市售食鹽是否為加碘鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗操作 | |
| A | 稱取2.0gNaOH固體 | 先在托盤上各放一張濾紙,然后在右盤上添加2g砝碼,左盤上添加NaOH固體 |
| B | 制備Fe(OH)3膠體 | 向沸騰的蒸餾水中逐滴加入少量氯化鐵飽和溶液,繼續加熱煮沸至液體變為紅褐色 |
| C | 檢驗溶液中是否含有SO42- | 取少量試液于試管中,先加入BaCl2溶液,再滴加稀鹽酸,若產生的白色沉淀不溶解,則說明溶液中含有SO42- |
| D | 萃取碘水中的碘 | 將碘水倒入分液漏斗,然后再注入酒精,振蕩,靜置分層后,下層液體從下口放出,上層液體從上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com