
分析 Ⅰ.根據元素周期律的遞變規律比較元素、單質以及對應化合物的性質,結合原子結構解答電子數為10的分子;
Ⅱ.根據原子最外層電子數和化合價判斷,在化合物中,原子最外層電子數等于原子的價層電子數+|化合價|,以此進行分析.
解答 解:Ⅰ.(1)在原子序數1-18號元素中,與水反應最劇烈的金屬是Na,金屬性最強,故答案為:Na;
(2)與水反應最劇烈的非金屬單質是F2,F元素的非金屬性最強,故答案為:F2;
(3)原子半徑最小的元素是H,原子核外只有1個電子,故答案為:H;
(4)最穩定氣態氫化物對應的元素的非金屬性應最強,為HF,故答案為:HF;
(5)電子數為10的分子式有:CH4、NH3、H2O、HF、Ne,故答案為:CH4、NH3、H2O、HF、Ne;
Ⅱ.①H2O中O元素化合價為-2,O原子最外層電子數為6,所以2+6=8,O原子滿足8電子結構;H元素化合價為+1,H原子最外層電子數為1,所以1+1=2,H原子不滿足8電子結構,故①錯誤;
②BF3中B元素化合價為+3,B原子最外層電子數為3,所以3+3=6,B原子不滿足8電子結構;F元素化合價為-1,F原子最外層電子數為7,所以1+7=8,F原子滿足8電子結構,故②錯誤;
③CCl4中C元素化合價為+4,C原子最外層電子數為4,所以4+4=8,C原子滿足8電子結構;Cl元素化合價為-1,Cl原子最外層電子數為7,所以1+7=8,Cl原子滿足8電子結構,故③正確;
④PCl3中P元素化合價為+3,P原子最外層電子數為5,所以3+5=8,分子中P原子滿足8電子結構;Cl元素化合價為-1,Cl原子最外層電子數為7,所以|-1|+7=8,分子中Cl原子滿足8電子結構,故④正確;
⑤SO3中S元素化合價為+6,S原子最外層電子數為6,所以=6+6=12,不滿足8電子結構,故⑤錯誤
⑥N2中,N與N原子之間有3個共用電子對,則N原子的最外層電子為5+3=8,滿足8電子穩定結構,故⑥正確;
⑦CO2中,C原子的族序數+成鍵數=4+4=8,所以滿足所有原子最外層為8電子結構,故⑦正確;
故答案為:③④⑥⑦.
點評 本題考查原子結構與元素周期律,比較基礎,注意對元素周期律的理解,注意識記常見10電子、18電子微粒,注意利用化合價與最外層電子數來分析是否滿足8電子結構,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:多選題
| A. | 18O2中含18個中子 | B. | 18O與16O中子數不同 | ||
| C. | N5和N2互為同位素 | D. | 2 N5=5 N2是化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 亞硝酸不穩定,易分解 | |
| B. | 0.1 mol•L-1的亞硝酸溶液的pH<7 | |
| C. | 把pH=2的亞硝酸溶液稀釋100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亞硝酸溶液恰好與100 mL l mol•L-1的NaOH溶液完全反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加A的物質的量 | B. | 升高體系的溫度 | C. | 減少C的物質的量 | D. | 增加體系的壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
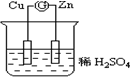 如圖所示的原電池裝置中,鋅為負極,電極發生的是氧化反應(填氧化或還原),電極反應式為Zn-2e-=Zn2+;銅電極反應式為2H++2e-=H2↑,銅片上觀察到的現象為有氣泡產生.
如圖所示的原電池裝置中,鋅為負極,電極發生的是氧化反應(填氧化或還原),電極反應式為Zn-2e-=Zn2+;銅電極反應式為2H++2e-=H2↑,銅片上觀察到的現象為有氣泡產生.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 500mL 0.4mol/L NaOH溶液 | B. | 400mL 0.15mol/L Na3PO4溶液 | ||
| C. | 300mL 0.5mol/L NaCl 溶液 | D. | 200mL 0.3mol/LNa2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油的分餾 | B. | 煤的干餾 | ||
| C. | 氧氣變臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol H2SO4的質量是98g•mol-1 | |
| B. | CO2的摩爾質量等于CO2的相對分子質量 | |
| C. | 0.012kg C-12里所含碳原子個數約為6.02×1023個 | |
| D. | 1mol任何物質的質量等于該物質的相對分子質量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com