
| 溫度/℃ | 1000 | 1100 |
| 平衡常數 | 0.68 | 0.50 |
分析 (1)①增大壓強,平衡向著方程式的系數減小的方向移動;
②升高溫度,化學平衡向著吸熱方向進行;
(2)據通過加熱引發鋁熱反應以及鋁熱反應為放熱反應以及溫度升高化學反應速率加快;
(3)①根據溫度和平衡常數以及反應的吸放熱之間的關系來回答;
②計算1000℃時CO的轉化率以及二氧化碳的平衡濃度,根據三行式計算比較.
解答 解:(1)mA?nB+pC△H,達到平衡狀態.
①若A、B、C都是氣體,增大壓強,平衡向方式的系數減小的方向移動,即平衡向正反應方向移動,則m>n+p,故答案為:大于;
②其他條件不變,升高溫度,化學平衡向著吸熱方向進行,即加熱后A的質量減小,則反應正向進行,△H>0,故答案為:大于;
(2)因通過加熱引發鋁熱反應,所以開始速率為零,一旦反應,反應放熱,溫度不斷升高,化學反應速率加快,故選:c;
(3)①該反應的K隨著溫度的升高而減小,所以反應釋放熱量,△H<0,故答案為:<;
②T℃時,將FeO(s)和CO(g)各3.0mol加入10L的密閉容器中,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始濃度:0.3 0.3 0 0
變化濃度:0.15 0.15
平衡濃度:0.15 0.15
CO轉化率為W1=$\frac{0.15}{0.3}$×100%=20%,c(CO2)=0.15mol•L-1,K=1>0.68,所以平衡正向移動了,該反應為放熱反應,所以此時溫度應低于1000℃,
由于氧化亞鐵和鐵都是固體,對平衡沒有影響,該反應是氣體計量數不變的反應,此時保持其它條件不變再充入2.0mol CO(g),則建立的平衡是等效的,所以再達平衡時測得CO轉化率為W2=W1,
故答案為:低于;=.
點評 本題是一道關于化學平衡常數的計算題,考查生化學平衡移動原理以及三行式的計算知識,屬于綜合知識的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
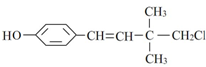 ,下列說法不正確的是( )
,下列說法不正確的是( )| A. | 有順反異構 | |
| B. | 可以和濃溴水發生取代反應和加成反應 | |
| C. | 可以發生加聚反應、水解反應和消去反應 | |
| D. | 1mol該化合物最多能與4 mol H2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=4.3的CH3COOH與CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 濃度為0.2mol/L的CH3COOH溶液和農地為0.1mol/L的NaOH溶液等體積混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀釋,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$幾乎不變 | |
| D. | amol/LCH3COOH溶液與bmol/LNaOH溶液等體積混合,所得溶液中c(Na+)>c(CH3COO-),則一定有a≤b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若溫度不變,容器體積擴大一倍,A的濃度是原來的0.45倍,則a+b>c+d | |
| B. | 若從正反應開始,平衡時,A、B的轉化率相等,則A、B的物質的量之比為b:a | |
| C. | 若平衡體系中共有氣體n mol,再向其中充入bmolB,達到平衡時氣體總物質的量為n+bmol,則a+b=c+d | |
| D. | 若a+b=c+d,則當容器內溫度上升時,平衡向左移動,容器中氣體的壓強不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水制取氫氣 | |
| B. | 大量設立水電站,用電力分解水制取氫氣. | |
| C. | 設法將太陽能聚焦,產生高溫,使水分解產生氫氣. | |
| D. | 尋找更多的化石燃料,利用其燃燒放熱,使水分解產生氫氣. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、NO2和CO2都屬于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都屬于烷烴 | |
| C. | 堿性氧化物都是金屬氧化物 | |
| D. | 在水溶液中能電離出H+的化合物都屬于酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 組分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 質量分數 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com