
已知2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1.向同溫、同體積的三個密閉容器中分別充入氣體:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒溫、恒容下反應達平衡時,下列關系一定正確的是
2SO3(g) ΔH=-197 kJ·mol-1.向同溫、同體積的三個密閉容器中分別充入氣體:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒溫、恒容下反應達平衡時,下列關系一定正確的是
A.容器內壓強P:P甲=P丙>2P乙
B.SO2的質量m:m甲=m丙>2m乙
C.c(SO2)與c(O2)之比k:k甲=k丙=2k乙
D.甲乙中SO2的轉化率分別為??甲、??乙,丙中SO3的轉化率為??丙:??甲>??乙,??甲+??丙=1
科目:高中化學 來源:2016-2017學年甘肅省高一上10月月考化學試卷(解析版) 題型:選擇題
①分液漏斗 ②容量瓶 ③長頸漏斗 ④蒸餾燒瓶
A. ①② B. ①②③ C. ②③④ D. ①②③④、
查看答案和解析>>
科目:高中化學 來源:2017屆福建省四地六校高三上第一次月考化學試卷(解析版) 題型:選擇題
使相同物質的量濃度的NaCl、MgCl2、AlCl3溶液中的Cl-  離子完全沉淀時,若所用相同濃度的AgNO3溶液的體積比為2:2:1,則上述三種溶液的體積比是( )
離子完全沉淀時,若所用相同濃度的AgNO3溶液的體積比為2:2:1,則上述三種溶液的體積比是( )
A.9:3:1 B.3:2:1 C.6:3:1 D.9:4:1
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省曲靖市高二上第一次月考化學卷(解析版) 題型:填空題
CH4、H2、C都是優質的能源物質,它們燃燒的熱化學方程式為:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一種甲烷細菌,它們依靠酶使甲烷與O2作用而產生的能量存活,甲烷細菌使1 mol甲烷生成CO2氣體與液態水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷與CO2可用于合成合成氣(主要成分是一氧化碳和氫氣):CH4+CO2= 2CO+2H2,1 g CH4完全反應可釋放15.46 kJ的熱量,則:

①上圖(所有物質均為氣態)能表示該反應過程中能量變化的是__________(填字母)。
②若將物質的量均為1 mol的CH4與CO2充入某恒容密閉容器中,體系放出的熱量隨時間的變化如圖所示,則CH4的轉化 率為 。
率為 。
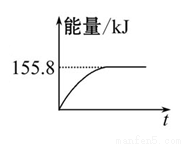
(3)C(s)與H2(g)不反應,所以C(s)+2H2(g)=CH4(g)的反應熱無法直接測量,但通過上述反應可求出C(s)+2H2(g)=CH4(g)的反應熱ΔH= 。
(4)目前對于上述三種物質的研究是燃料研究的重點,下列關于上述三種物質的研究方向中可行的是_____________(填字母)。
A.尋找優質催化劑,使CO2與H2O反應生成CH4與O2,并放出熱量
B.將固態碳合成為C60,以C60作為燃料
C.尋找優質催化劑,利用太陽能使大氣中的CO2與海底開采的CH4合成合成氣(CO、H2)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省曲靖市高二上第一次月考化學卷(解析版) 題型:選擇題
已知25℃、101kPa條件下:①4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = - 2834.9 kJ/mol; ②4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = - 3119.91kJ/mol。由此得出的結論正確的是( )
A.等質量的O2比O3能量低,由O2變O3 為吸熱反應
B.等質量的O2比O3能量低,由O2變O3 為放熱反應
C.O3比O2穩定,由O2變O3 為吸熱反應
D.O 2比O3穩定,由O2變O3 為
2比O3穩定,由O2變O3 為 放熱反應
放熱反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高二上10月月考化學試卷(解析版) 題型:選擇題
在1.0 L密閉容器中放入0.10 mol X,在一定溫度下發生反應:X(g) Y(g)+Z(g) ?H<0容器內氣體總壓強p隨反應時間t的變化關系如下圖所示。以下分析正確的是
Y(g)+Z(g) ?H<0容器內氣體總壓強p隨反應時間t的變化關系如下圖所示。以下分析正確的是

A.從反應開始到t1時的平均反應速率
v(X)= mol/(L·min)
mol/(L·min)
B.該溫度下此反應的平衡常數K=0.32
C.欲提高平衡體系中Y的含量,可升高體系溫度或減少Z的量
D.其他條件不變,再充入0.1 mol 氣體X,平衡正向移動,X的轉化率增大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高二上10月月考化學試卷(解析版) 題型:選擇題
對于可逆反應N2(g)+3H2(g)  2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是
2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是
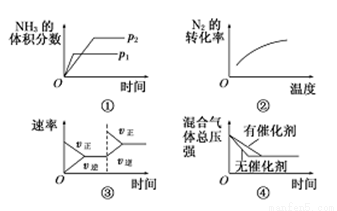
A.①壓強對反應的影響(p2>p1)
B.②溫度對反應的影響
C.③平衡體系增加N2對反應的影響
D.④催化劑對反應的影響
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省高一上第一次大考化學卷(解析版) 題型:實驗題
分實驗室需要450 mL 1.0 mol·L-1的硫酸溶液,某小組的同學設計如下實驗步驟并依此進行配制,請回答相關問題。(已知所用98%濃硫酸的密度為1.84 g/mL)
①計算需98%的濃硫酸的體積;
②在燒杯中將濃硫酸稀釋;
③接著將稀釋后的硫酸轉移到容量瓶中;
④洗滌燒杯和玻璃棒3次,并將洗滌液轉移到容量瓶中;
⑤定容;
⑥搖勻。
(1)該實驗中選用的定量儀器,除量筒外,還有________________。
(2)該實驗應該用(多大規格)_____ ______的量筒(可供選擇的量筒規格為10 mL、15 mL、20 mL、50 mL和100 mL),量取___________mL 98%的濃硫酸。
(3)①在配制過程中,如果沒有洗滌燒杯和玻璃棒,其他操作都正確,那么所配溶液的實際濃度將_____________(填“偏大、偏小、無影響”)
②某同學轉移溶液的操作如圖所示,該同學操作中的錯誤是 。
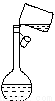
③若用膠頭滴管定容時,不小心滴水滴過了刻度線,你認為應該采取的處理方法是: 。
④下列操作中,可能造成所配制溶液的濃度偏高的是 (填選項)。
a.溶解后沒有冷卻至室溫就將液體轉移至容量瓶中
b.定容時,俯視刻度線
c.洗滌后的容量瓶中殘留少量蒸餾水
d.用量筒量取濃硫酸,讀數時仰視刻度線
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高一上開學考試化學試卷(解析版) 題型:選擇題
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判斷有關離子的還原性從強到弱的順序是( )
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I ->Fe2+ D.Fe2+>I->Br-
->Fe2+ D.Fe2+>I->Br-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com