

分析 錳鋅鐵氧體(ZnaMnbFecO4,Fe元素為+3價,Zn、Mn元素化合價相同)加鹽酸溶解,再加(NH4)2S2O8把錳離子氧化為二氧化錳,過濾,濾液中含有鐵離子和鋅離子,加NaF和緩沖溶液掩蔽鐵,最后測定鋅;
(1)ZnaMnbFecO4,Fe元素為+3價,Zn為+2價,Zn、Mn元素化合價相同,根據化合價的代數和為零計算;
(2)(NH4)2S2O8把錳離子氧化為二氧化錳,同時生成硫酸根離子;
(3)根據配制250mL溶液的步驟分析;
(4)根據Zn2++H2Y2-=ZnY2-+2H+,由消耗的標準溶液的物質的量計算Zn2+的物質的量,再求出250mL溶液中Zn2+的物質的量和質量,然后求出鐵氧體中ZnO的質量分數.
解答 解:錳鋅鐵氧體(ZnaMnbFecO4,Fe元素為+3價,Zn、Mn元素化合價相同)加鹽酸溶解,再加(NH4)2S2O8把錳離子氧化為二氧化錳,過濾,濾液中含有鐵離子和鋅離子,加NaF和緩沖溶液掩蔽鐵,最后測定鋅;
(1)ZnaMnbFecO4,Fe元素為+3價,Zn為+2價,Zn、Mn元素化合價相同,則2a+2b+3c+(-2)×4=0,則2a+2b+3c=8,
故答案為:2a+2b+3c=8;
(2)(NH4)2S2O8把錳離子氧化為二氧化錳,同時生成硫酸根離子,其反應的離子方程式為:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
故答案為:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(3)配制250mL溶液,先在燒杯中溶解藥品,用玻璃棒攪拌,轉移到250mL容量瓶,定容,故答案為:250mL容量瓶;
(4)由Zn2++H2Y2-=ZnY2-+2H+,可知Zn2+的物質的量n(Zn2+)=n(H2Y2-)=0.01000mol•L-1×0.0200L,
則250mL溶液中Zn2+的物質的量為n(Zn2+)=0.01000mol•L-1×0.0200L×$\frac{250mL}{25mL}$,
則ZnO的質量為0.01000mol•L-1×0.0200L×$\frac{250mL}{25mL}$×81g/mol=0.162g,
所以該鐵氧體中ZnO的質量分數$\frac{0.162g}{1.000g}$×100%=16.2%;
故答案為:16.2%.
點評 本題以工業流程圖為依托,考查了化學式的計算、離子方程式的書寫、溶液的配制等,題目難度中等,解題關鍵是合理分析題中流程及準確把握物質的性質,試題培養了學生分析、理解能力及靈活應用所學知識的能力.


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 將甲烷和乙烯的混合氣體通過酸性高錳酸鉀溶液,可除去乙烯 | |
| B. | 配制銀氨溶液:在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解為止 | |
| C. | 驗證RX為碘代烷,把RX與燒堿水溶液混合加熱,將溶液冷卻后再加入硝酸銀溶液 | |
| D. | 無水乙醇和濃硫酸共熱至170℃,將制得的氣體通入酸性高錳酸鉀可檢驗制得的氣體是否為乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
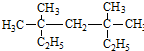 系統命名為3,3,5,5-四甲基庚烷;
系統命名為3,3,5,5-四甲基庚烷;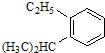 的芳香炔烴的結構簡式
的芳香炔烴的結構簡式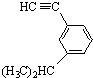 ;
;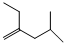 .
.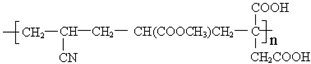
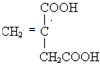 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ③⑥ | D. | ③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. |  如圖裝置可用于制備乙酸乙酯 | |
| B. |  如圖裝置可用于模擬海水蒸餾 | |
| C. |  如圖裝置可用于探究碳酸氫鈉的熱穩定性 | |
| D. |  如圖裝置為配制溶液過程中的定容操作 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可吸入顆粒 | B. | 氮氣 | C. | 氧氣 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 控制含磷洗滌劑的生產和使用,防止水體富營養化,保護水資源 | |
| B. | CO2、NO2或SO2都會導致酸雨的形成 | |
| C. | 硅是一種灰黑色的金屬單質,是現代信息產業的重要元素 | |
| D. | 白磷著火點高且無毒,可用于制造安全火柴 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com