12.8g銅片與某濃度的硝酸反應,生成氣體的體積在標準狀況下為4.48L.銅和硝酸反應的化學方程式為:
Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
試計算:
(1)被還原的硝酸的物質的量
(2)4.48L氣體中各成分的物質的量.
【答案】
分析:(1)銅與硝酸反應生成的氣體無論是NO還是NO
2,一個氣體分子中含有一個N原子,一個硝酸分子中含有一個N原子,根據原子守恒,氣體的物質的量與被還原的硝酸的物質的量相等.
(2)銅與硝酸反應中,銅失電子作還原劑,硝酸得電子作氧化劑,在氧化還原反應中得失電子數相等,利用電子守恒,列方程組,得出NO、NO
2的物質的量.
解答:解:(1)設氣體的平均分子式為NO
x,被還原的硝酸的物質的量為y,
標準狀況下生成氣體的物質的量為
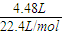
=0.2mol,氣體分子與被還原的硝酸的關系式為
HNO
3--NOx
1 1
ymol 0.2mol
y=0.2mol,
答:被還原的硝酸的物質的量為0.2mol;
(2)銅與硝酸反應中,銅失電子作還原劑,硝酸得電子作氧化劑,在氧化還原反應中得失電子數相等,利用電子守恒,列方程組,得出NO、NO
2的物質的量.
銅的物質的量為
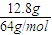
=0.2mol,則0.2molCu變成Cu
2+失去的電子為0.2mol×2=0.4mol,
設生成NO的物質的量為mmol,NO
2的物質的量為nmol,混合氣體的物質的量為0.2mol,即
m+n=0.2
由氧化還原反應中得失電子數相等得;
3m+n=0.4
列方程組
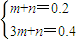
,解得m=0.1mol,n=0.1mol,
答:4.48L氣體中NO為0.1mol,NO
2的物質的量為0.1mol.
點評:本題考查的是硝酸的性質及結合方程式的計算,巧妙利用守恒法、關系式進行計算,有事半功倍之效.估算法、差量法、平均值法等都是做題時常用的方法.

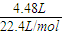 =0.2mol,氣體分子與被還原的硝酸的關系式為
=0.2mol,氣體分子與被還原的硝酸的關系式為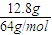 =0.2mol,則0.2molCu變成Cu2+失去的電子為0.2mol×2=0.4mol,
=0.2mol,則0.2molCu變成Cu2+失去的電子為0.2mol×2=0.4mol,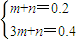 ,解得m=0.1mol,n=0.1mol,
,解得m=0.1mol,n=0.1mol,

 閱讀快車系列答案
閱讀快車系列答案