
| A. | pH=a的醋酸溶液,稀釋10倍后,其pH=b,則a=b-1 | |
| B. | 含等物質的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1鹽酸與0.2mol•L-1氨水等體積混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固體的懸濁液:c(Ag+)>c(Cl-)=c(I-) |
分析 A.醋酸是弱電解質,加水稀釋時促進醋酸電離,稀釋10倍后,氫離子濃度大于原來的$\frac{1}{10}$;
B.任何電解質溶液中都存在物料守恒,根據物料守恒判斷;
C.0.1mol•L-1鹽酸與0.2mol•L-1氨水等體積,溶液中溶質為等物質的量濃度的NH3•H2O和NH4Cl,NH3•H2O電離程度大于銨根離子水解程度導致溶液呈堿性,但NH3•H2O電離程度較小;
D.AgCl溶解度大于AgI.
解答 解:A.醋酸是弱電解質,加水稀釋時促進醋酸電離,稀釋10倍后,氫離子濃度大于原來的$\frac{1}{10}$,所以a>b-1,故A錯誤;
B.任何電解質溶液中都存在物料守恒,根據物料守恒得2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)],故B正確;
C.0.1mol•L-1鹽酸與0.2mol•L-1氨水等體積,溶液中溶質為等物質的量濃度的NH3•H2O和NH4Cl,NH3•H2O電離程度大于銨根離子水解程度導致溶液呈堿性,但NH3•H2O電離程度較小,所以離子濃度大小順序是c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故C錯誤;
D.AgCl溶解度大于AgI,所以離子濃度大小順序是c(Ag+)>c(Cl-)>c(I-),故D錯誤;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,明確溶液中溶質及其性質是解本題關鍵,注意弱電解質電離特點,注意:任何電解質溶液中都存在電荷守恒和物料守恒,與溶質種類多少及溶解度無關,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 實驗①中溶液呈藍色,試管口有紅棕色氣體產生,說明稀硝酸被Cu還原為NO2 | |
| B. | 實驗③中滴加稀硫酸,銅片繼續溶解,說明稀硫酸的氧化性比稀硝酸強 | |
| C. | 實驗③發生反應的化學方程式為:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O | |
| D. | 由上述實驗可得出結論:Cu在常溫下既可以和稀硝酸反應,也可以和稀硫酸反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
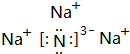 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
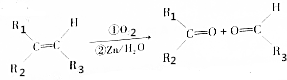
 和
和 各1mol.
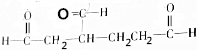
各1mol.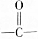 ),產物與烴分子中原子個數相等的元素有C、H.
),產物與烴分子中原子個數相等的元素有C、H. 可簡寫為
可簡寫為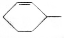 ,其中線表示化學鍵,線的端點、折點或交點表示碳原子,碳原子剩余的化合價用氫原子補足.寫出A所有可能的結構簡式:
,其中線表示化學鍵,線的端點、折點或交點表示碳原子,碳原子剩余的化合價用氫原子補足.寫出A所有可能的結構簡式: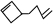 、
、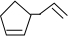 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 投料比[n(NO2):n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
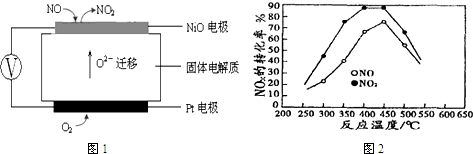
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:A<B<C<D<E | |
| B. | 化合物AE與CE含有相同類型的化學鍵 | |
| C. | 簡單氣態氫化物的熱穩定性:B>E | |
| D. | 一定條件下,元素C、D的最高價氧化物對應的水化物之間能發生反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com