
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(開始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 溫度范圍/℃ | 固體質量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
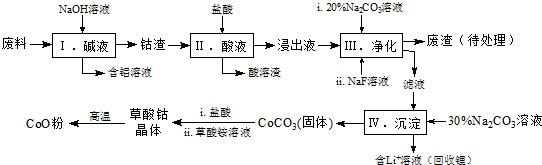
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol]. 分析 該工藝流程為:廢料加入氫氧化鈉溶液堿浸,得到鈷渣,加入鹽酸溶解后發生氧化還原反應,氧化鈷氧化氯離子為氯氣,過濾得到酸溶的溶液加入碳酸鈉溶液和NaF溶液凈化,除去鋰離子和鐵離子,在濾液中加入碳酸鈉溶液沉淀鈷離子為碳酸鈷沉淀,加入鹽酸和草酸銨溶液得到草酸鈷晶體,高溫分解得到氧化鈷;
(1)步驟Ⅰ中鋁與氫氧化鈉反應生成偏鋁酸鈉和氫氣;
(2)Co2O3與鹽酸反應生成Cl2,依據得失電子守恒結合原子個數守恒寫成反應的離子方程式;
(3)依據表中數據分析判斷加入碳酸鈉調節溶液PH,沉淀鐵離子和鋰離子,但不能沉淀鈷離子;
(4)NaF與溶液中的Li+形成LiF沉淀,防止鋰離子結合碳酸根離子形成碳酸鋰沉淀;
(5)①計算晶體物質的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去結晶水應為0.06mol,固體質量變化=0.06mol×18g/mol=1.08g,圖表數據可知,150℃~210℃固體質量變化=5.49g=4.41g=1.08g,說明210℃失去結晶水得到CoC2O4;
②210℃~290℃過程中是CoC2O4發生的反應,210℃~290℃過程中產生的氣體只有CO2 ,依據元素守恒得到生成CO2物質的量為0.06mol,質量=0.06mol×44g/mol=2.64g,氣體質量共計減小=4.41g-2.41g=2g,說明不是分解反應,參加反應的還有氧氣,則反應的氧氣質量=2.64g-2g=0.64g,O2物質的量=$\frac{0.064g}{32g/mol}$=0.02mol,依據原子守恒配平書寫反應的化學方程式.
解答 解:(1)步驟Ⅰ中鋁與氫氧化鈉反應生成偏鋁酸鈉和氫氣,反應的離子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3與鹽酸反應生成Cl2,反應中鈷元素化合價降低為+2價.氯元素化合價-1價變化為0價,依據得失電子守恒可知Co2O3的系數為1,Cl-的系數為2,結合原子個數守恒,反應的離子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案為:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依據表中數據分析判斷加入碳酸鈉調節溶液PH,沉淀鐵離子和鋰離子,但不能沉淀鈷離子,步驟Ⅲ中Na2CO3溶液的作用是調節溶液的pH,應使溶液的pH不超過7.15,廢渣中的主要成分除了LiF外還有Fe(OH)3;
故答案為:7.15;Fe(OH)3;
(4)NaF與溶液中的Li+形成LiF沉淀,此反應對步驟Ⅳ所起的作用是,降低溶液中Li+濃度,避免步驟Ⅳ中產生Li2CO3沉淀;
故答案為:降低溶液中Li+濃度,避免步驟Ⅳ中產生Li2CO3沉淀;
(5))①計算晶體物質的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去結晶水應為0.06mol,固體質量變化=0.06mol×18g/mol=1.08g,圖表數據可知,150℃~210℃固體質量變化=5.49g=4.41g=1.08g,說明210℃失去結晶水得到CoC2O4;
故答案為:失去結晶水;
②210℃~290℃過程中是CoC2O4發生的反應,產生的氣體只有CO2 ,依據元素守恒得到生成CO2物質的量為0.06mol,質量=0.06mol×44g/mol=2.64g,氣體質量共計減小=4.41g-2.41g=2g,說明說明有氣體參加反應應為氧氣,則反應的氧氣質量=2.64g-2g=0.64g,O2物質的量=$\frac{0.064g}{32g/mol}$=0.02mol,則:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式計量系數之比等于轉化量之比,所以該反應的方程式為:3CoC2O4+2O2
故答案為:3CoC2O4+2O2
點評 本題通過從某工業廢料中回收鈷的工藝流程考查了化學方程式、離子方程式書寫,確各個階段固體成分及先后分解生成物成分是解本題關鍵,題目難度中等.


 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案 天天向上課時同步訓練系列答案
天天向上課時同步訓練系列答案 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源: 題型:選擇題
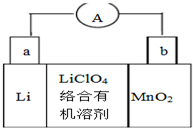 鋰錳電池的體積小、性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4.溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2.下列有關說法正確的是( )
鋰錳電池的體積小、性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4.溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2.下列有關說法正確的是( )| A. | 外電路的電流方向是由a極流向b極 | |
| B. | 電池正極反應式為MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替電池中的混合有機溶劑 | |
| D. | 每轉移0.1mol電子,理論上消耗Li的質量為3.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
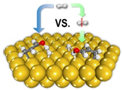 2013年《美國化學會志》發表了我國科學家對非均相催化加氫過程機理研究的成果,其原理如圖.下列關于氫氣的說法不正確的是( )
2013年《美國化學會志》發表了我國科學家對非均相催化加氫過程機理研究的成果,其原理如圖.下列關于氫氣的說法不正確的是( )| A. | 由氫原子構成的氫氣分子只有一種 | |
| B. | 通常情況下,氣體中氫氣的密度最小 | |
| C. | 氫氣可用于生產鹽酸、氨氣等化工產品 | |
| D. | 目前,工業上不采用電解水的方法大量生產氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
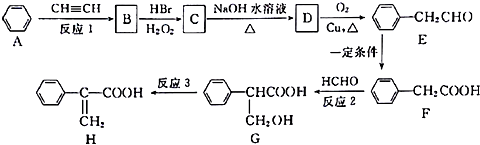
 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,pH=13的1.0 L Ba(OH)2溶液中含有的OH-數目為0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA個H+ | |
| C. | 將4 g NaOH溶于100 g蒸餾水中,所得溶液物質的量濃度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的電子數為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | XQ2W分子在常溫下呈氣態,分子中的四個原子在同一平面內 | |
| B. | Z和W形成的兩種離子化合物中陰、陽離子個數比均為2:1 | |
| C. | X、W兩元素分別和Q元素化合,可形成電子數相同的兩種化合物 | |
| D. | 相應的離子半徑大小關系為:Y>W>Z |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向水中加入少量固體硫酸氫鈉,恢復原溫度時,c(H+)增大,Kw變大 | |
| B. | 體積、pH均相同的醋酸和鹽酸完全溶解等量的鎂粉(少量),后者用時少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀釋,$\frac{c({H}^{+})}{c(O{H}^{-})}$減小 | |
| D. | 常溫下,V1LpH=11的NaOH溶液與V2LpH=3的HA溶液混合,若混合液顯中性,則V1≤V2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
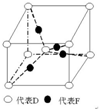 在元素周期表前四周期中原子序數依次增大的六種元素A、B、C、D、E、F中,A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C的氧化物是導致酸雨的主要物質之一,D原子核外電子有8種不同的運動狀態,E的基態原子在前四周期元素的基態原子中單電子數最多,F元素的基態原子最外能層只有一個電子,其它能層均已充滿電子.
在元素周期表前四周期中原子序數依次增大的六種元素A、B、C、D、E、F中,A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C的氧化物是導致酸雨的主要物質之一,D原子核外電子有8種不同的運動狀態,E的基態原子在前四周期元素的基態原子中單電子數最多,F元素的基態原子最外能層只有一個電子,其它能層均已充滿電子. ; A2D由液態形成晶體時密度減小(填增大,不變或減小),分析主要原因(用文字敘述)水形成晶體時,每個水分子與4個水分子形成氫鍵,構成空間正四面體網狀結構,水分子空間利用率低,密度反而減小.
; A2D由液態形成晶體時密度減小(填增大,不變或減小),分析主要原因(用文字敘述)水形成晶體時,每個水分子與4個水分子形成氫鍵,構成空間正四面體網狀結構,水分子空間利用率低,密度反而減小.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 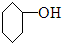 $\stackrel{濃H_{2}SO_{4}△}{→}$ $\stackrel{濃H_{2}SO_{4}△}{→}$ +H2O +H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O | |
| C. | 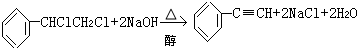 | |
| D. | 2CH3OH$→_{△}^{濃硫酸}$CH3-O-CH3+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com