
【題目】高分子材料尼龍66具有良好的抗沖擊性、韌性、耐燃油性和阻燃、絕緣等特點,因此廣泛應用于汽車、電氣等工業中。以下是生產尼龍66的一些途徑。
(1)A的結構簡式為_____________。
(2)B中官能團的名稱是_____________。
(3)反應①~④中,屬于加成反應的有_______,反應⑥~⑨中,屬于氧化反應的有_______。
(4)請寫出反應⑥的化學方程式_____________。
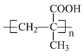
(5)高分子材料尼龍66中含有![]() 結構片段,請寫出反應⑩的化學方程式_____________。
結構片段,請寫出反應⑩的化學方程式_____________。
(6)某聚合物K的單體與A互為同分異構體,該單體核磁共振氫譜有三個峰,峰面積之比為1:2:3,且能與NaHCO3溶液反應,則聚合物K的結構簡式是_____________。
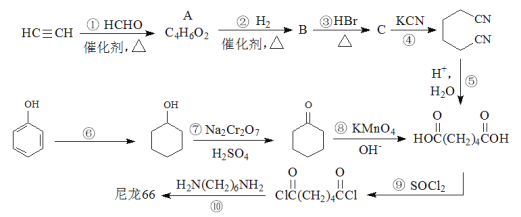
(7)聚乳酸(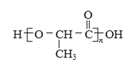 )是一種生物可降解材料,已知羰基化合物可發生下述
)是一種生物可降解材料,已知羰基化合物可發生下述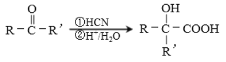 反應: (R′可以是烴基或H原子)。用合成路線圖表示用乙醇制備聚乳酸的過程。_______________
反應: (R′可以是烴基或H原子)。用合成路線圖表示用乙醇制備聚乳酸的過程。_______________
【答案】HOCH2C≡CCH2OH![]() 羥基 ①② ⑦⑧
羥基 ①② ⑦⑧ 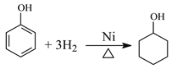
![]()

【解析】
結合A的分子式和C后的產物,可知1分子乙炔與2分子甲醛發生加成反應生成A,故A的結構簡式為HOCH2C≡CCH2OH;A與氫氣發生加成反應生成B,B為HOCH2CH2CH2CH2OH,B與HBr發生取代反應生成C,C的結構簡式為BrCH2CH2CH2CH2Br,C與KCN發生取代反應生成NCCH2CH2CH2CH2CN,然后NCCH2CH2CH2CH2CN水解生成HOOCCH2CH2CH2CH2COOH,苯酚與氫氣發生加成反應生成環己醇,環己醇發生催化氧化生成環己酮,環己酮發生氧化反應HOOCCH2CH2CH2CH2COOH,HOOCCH2CH2CH2CH2COOH與SOCl2發生取代反應生成ClCO(CH2)4COCl,ClCO(CH2)4COCl與H2N(CH2)6NH2發生縮聚反應,生成高分子材料尼龍66。
(1)結合A的分子式和C后的產物,可知1分子乙炔與2分子甲醛發生加成反應生成A,故A的結構簡式為HOCH2C≡CCH2OH;
(2)A與氫氣發生加成反應生成B,B為HOCH2CH2CH2CH2OH,B中官能團的名稱是羥基;
(3)反應①、②是加成反應,反應③、④為取代反應;
(4)反應⑥是苯酚與氫氣發生加成反應生成環己醇,反應方程式為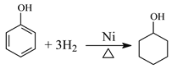 ;
;
(5)高分子材料尼龍66中含有![]() 結構片段,ClCO(CH2)4COCl與H2N(CH2)6NH2發生縮聚反應,生成高分子材料尼龍66,反應方程式為
結構片段,ClCO(CH2)4COCl與H2N(CH2)6NH2發生縮聚反應,生成高分子材料尼龍66,反應方程式為![]() ;
;
(6)某聚合物K的單體與A(HOCH2C≡CCH2OH)互為同分異構體,該單體能與NaHCO3溶液反應,故該單體中含有羧基,該單體核磁共振氫譜有三個峰,峰面積之比為1:2:3,所以該單體的結構簡式為CH2=C(CH3)COOH,該聚合物K的結構簡式為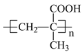 ;
;
(7)由HOCH(CH3)COOH發生縮聚反應生成聚乳酸(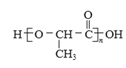 ),乙醇發生催化氧化生成乙醛,乙醛與HCN發生反應后在水解條件下生成HOCH(CH3)COOH,合成路線如圖所示
),乙醇發生催化氧化生成乙醛,乙醛與HCN發生反應后在水解條件下生成HOCH(CH3)COOH,合成路線如圖所示 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某小組同學利用圖1裝置(夾持儀器已省略)制備溴苯,并探究該反應原理。
Ⅰ.制備溴苯
(1)裝置中長導管a的作用是__________、導出氣體。
(2)本實驗所獲得的溴苯為褐色,是因為_________.
Ⅱ.分離提純
已知,溴苯與苯互溶,液溴、苯、溴苯的沸點依次為59℃、80℃、156℃。同學們設計了如圖2流程:
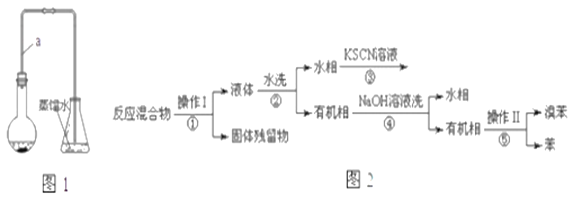
(3)操作Ⅱ為________.
(4)流程②和④中,需要用到的玻璃儀器是燒杯、___;流程③的現象為____,流程④的作用是_____.
Ⅲ.探究原理
(5)反應結束后,某同學取少量錐形瓶中的液體于試管中,再滴入幾滴AgNO3溶液,出現淺黃色渾濁,從而判斷反應一定生成了HBr,你認為該同學的判斷________(填“合理”、“不合理”)。
(6)為探究錐形瓶中溶液的離子,請完成如表探究實驗方案(限選試劑:鎂粉、四氯化碳、氯水、溴水、蒸餾水)
實驗步驟 | 預期現象 | 結論 |
1.將錐形瓶中的液體轉入分液漏斗,加足量①__,振蕩后分液。分別取少量②_層溶液于試管A、B中 | _______ | ______ |
2.向試管A中加入少量③___和四氯化碳,振蕩后靜置; | 溶液分層,下層顯④___色 | 錐形瓶中液體含大量Br |
3.向試管B中加入⑤___. | 有汽泡生成 | 錐形瓶中液體含大量⑥___ |
根據上述結論推斷,制備溴苯的反應屬于___反應,其反應方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中藥麻黃成分中含有生物堿、黃酮、鞣質、揮發油、有機酚、多糖等許多成分,其中一種有機酚的結構簡式如圖。下列說法正確的是 ( )
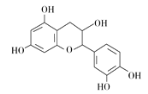
A. 分子中所有碳原子可以處于同一平面
B. 分子式為C15H12O7
C. 1 mol該有機物跟足量濃溴水反應,最多消耗5 mol Br2
D. 1 mol該有機物與NaOH溶液反應最多消耗5 mol NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項中指定的比值是2∶1的是 ( )
A. C2H4在氧氣中充分燃燒生成的CO2與H2O的物質的量之比
B. K2S溶液中c(K+)與c(S2-)之比
C. Na2O2晶體中陽離子與陰離子的物質的量之比
D. CsCl晶體中陰、陽離子的配位數比
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于乙炔的說法錯誤的是 ( )
A. 乙炔的鍵角為180°,是非極性分子
B. 碳原子sp雜化軌道形成σ鍵、未雜化的兩個2p軌道形成兩個π鍵,且互相垂直
C. 碳碳三鍵中三條鍵能量大小相同,其鍵長是碳碳單鍵的![]()
D. 乙炔分子中既有極性鍵也有非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸亞乙酯是鋰離子電池低溫電解液的重要添加劑,其結構如下圖。下列有關該物質的說法不正確的是
![]()
A. 分子式為C3H4O3B. 分子中σ鍵與π鍵個數之比為3:1
C. 分子中既有極性鍵也有非極性鍵D. 分子中碳原子的雜化方式全部為sp2雜化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三種形態的粒子的物質的量分數(分布系數)δ隨溶液pH變化的關系如圖所示,下列說法正確的是
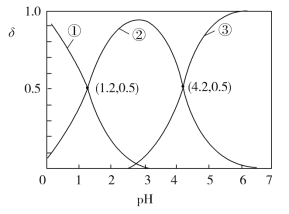
A.曲線①代表的粒子是HC2O4-
B.H2C2O4的Ka1=-1.2
C.向草酸溶液中滴加KOH溶液至pH=4.2:c(K+)<3c(C2O42-)
D.濃度均為0.01 mol·L1的草酸與KOH溶液等體積混合并充分反應得到的溶液:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下氨氣能被氯氣氧化生成N2,化工廠常用此法檢驗管道是否泄漏氯氣。某探究小組在實驗室對氨氣與氯氣反應進行了探究,回答下列問題。
Ⅰ.氨氣的制備
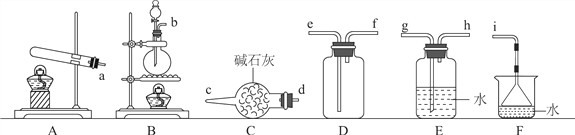
(1)氨氣的發生裝置可以選擇上圖中的________(填大寫字母),反應的化學方程式為____________________________________。
(2)欲收集一瓶干燥的氨氣,選擇上圖中的裝置,按氣流方向寫出其接口的連接順序:發生裝置管口→________(填小寫字母)。
Ⅱ.氯氣與氨氣的反應
室溫下,用收集到的氨氣按下圖所示裝置進行實驗(實驗前k1、k2關閉)。
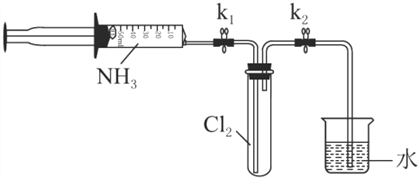
(3)打開k1,緩緩推動注射器活塞,向試管中注入約3倍于氯氣體積的氨氣,關閉k1,恢復室溫。試管中可觀察到的現象是________。發生反應的化學方程式為________。
(4)再打開k2,可觀察到的現象是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)廣泛用于電鍍、鞣制皮革、棉織品漂白后的脫氯劑等。某實驗小組的同學以Na2S和SO2為原料制備Na2S2O3。回答下列問題:
(1)制備Na2S溶液
①Na2S溶液呈堿性,原因是____________________________(用離子方程式表示)。
②工業品硫化鈉中常含有少量Na2SO4和Na2CO3,需進行純化,他們將硫化鈉溶于水,然后加入適量的_____________(填化學式)溶液充分攪拌并過濾,再精制得Na2S溶液。
(2)利用下圖裝置制備Na2S2O3
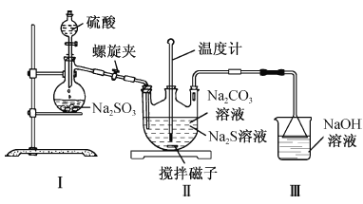
①裝置Ⅰ中反應的化學方程式為___________________________________。
②實驗過程中打開螺旋夾并調節螺旋夾至適當的位置,一方面使反應產生的SO2氣體較均勻地通入Na2S—Na2CO3溶液中,另一方面的作用是______________________________。
③三口燒瓶內生成Na2S2O3的化學方程式為;____________________________________;裝置Ⅲ的作用是_________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com