
【題目】UO2與鈾氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3]![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
回答下列問題:
(1)基態氮原子價電子排布圖為______。
(2)反應所得氣態化合物中屬于非極性分子的是_______(填化學式)。
(3)某種鈾氮化物的晶體結構是NaCl型。NaCl的Bom-Haber循環如圖所示。已知:元素的一個氣態原子獲得電子成為氣態陰離子時所放出的能量稱為電子親和能。下列有關說法正確的是________(填標號)。
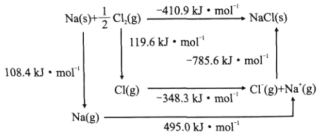
a.Cl-Cl鍵的鍵能為119.6kJ/mol b.Na的第一電離能為603.4kJ/mol
c.NaCl的晶格能為785.6kJ/mol d.Cl的第一電子親和能為348.3kJ/mol
(4)依據VSEPR理論推測CO32-的空間構型為_________。分子中的大丌鍵可用符號丌![]() 表示,其中m代表參與形成大丌鍵的原子數,n代表參與形成大丌鍵的電子數(如苯分子中的大丌鍵可表示為丌
表示,其中m代表參與形成大丌鍵的原子數,n代表參與形成大丌鍵的電子數(如苯分子中的大丌鍵可表示為丌![]() ),則CO32-中的大丌鍵應表示為_____
),則CO32-中的大丌鍵應表示為_____
(5)UO2可用于制備UF4:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的結構表示為[F—H…F]-,反應中斷裂的化學鍵有_______ (填標號)。
2UF4·2NH4F+3NH3↑+4H2O,其中HF2的結構表示為[F—H…F]-,反應中斷裂的化學鍵有_______ (填標號)。
a.氫鍵 b.極性鍵 c.離子鍵 d.金屬鍵 e.非極性鍵
(6)鈾氮化物的某兩種晶胞如圖所示:
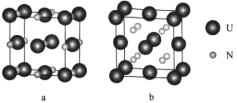
①晶胞a中鈾元素的化合價為__________,與U距離相等且最近的U有_______個。
②已知晶胞b的密度為dg/cm3,U原子的半徑為r1cm,N原子的半徑為為r2cm,設NA為阿伏加德羅常數的值,則該晶胞的空間利用率為___________(列出計算式)。
【答案】![]() CO2 c、d 平面三角形
CO2 c、d 平面三角形 ![]() b、c +3 12
b、c +3 12 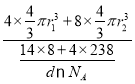 ×100%
×100%
【解析】
(1)先根據構造原理,書寫N的核外電子排布式,然后可根據各個能級具有的軌道數及軌道電子填充電子規律,得到基態氮原子價電子排布圖;
(2)反應所得氣態化合物分子有NH3、CO2、N2、H2O,根據分子是否對稱判斷是否為非極性分子;
(3)根據圖示的能量變化結合化學基本概念分析判斷;
(4)根據價層電子對互斥理論分析判斷;C原子、O原子有平行的p軌道,價電子總數為4+2+6×3=24,單電子數=24-2×3-4×3=6,為4原子、6電子形成的大π鍵;
(5) NH4HF2為離子晶體,含有離子鍵,HF2-含有氫鍵和共價鍵,NH4+中含有配位鍵和共價鍵;
(6)①用均攤方法計算a中U、N原子個數比,然后根據N元素化合價分析U元素化合價;在晶體中與U距離相等且最近的U原子在晶胞面心,然后根據通過一個U原子的晶胞數及重合數目計算其微粒數目;
②先計算1個晶胞中含有的U、N原子數目,然后計算晶胞的體積及一個晶胞中含有的U、N原子數目的總體積,最后根據原子體積占總體積的百分比可得其空間利用率。
(1)N是7號元素,根據構造原理,可得其核外電子排布式1s22s22p3,其價電子的軌道表達式為![]() ;
;
(2)反應所得氣態化合物分子有NH3、CO2、N2、H2O,NH3、H2O的空間排列不對稱,正負電荷的重心不重合,屬于極性分子,CO2、N2的空間排列對稱,分子中正負電荷重心重合,是非極性分子,其中CO2是非極性化合物分子;
(3) a.Cl-Cl鍵的鍵能為2×119.6kJ/mol=239.2kJ/mol,a錯誤;
b.Na的第一電離能為495.0kJ/mol,b錯誤;
c.NaCl的晶格能為785.6kJ/mol,c正確;
d.Cl的第一電子親和能為348.3kJ/mol,d正確;
故合理選項是cd;
(4) CO32-的價層電子對數為3+![]() =3,因此CO32-空間構型為平面三角形;
=3,因此CO32-空間構型為平面三角形;
C原子、O原子有平行的p軌道,價電子總數為4+2+6×3=24,單電子數=24-2×3-4×3=6,為4原子、6電子形成的大π鍵,大π鍵為![]() ;
;
(5) NH4HF2為離子晶體,含有離子鍵,HF2-含有氫鍵和共價鍵,NH4+中含有配位鍵和共價鍵,所以NH4HF2中所含作用力有:a、b、c、d,反應中斷裂的化學鍵有b、c;
(6)①晶胞a中U原子個數8×![]() +6×
+6×![]() =4;含有N原子個數為:12×
=4;含有N原子個數為:12×![]() +1=4,因此一個晶胞中含有U、N原子個數均為4個,化學式為UN,由于N原子最外層有5個電子,N化合價為-3價,所以U元素的化合價為+3,根據圖示可知:在晶胞與U距離相等且最近的U在一個晶胞的面心上,通過一個U原子有8個晶胞,在一個晶胞中有3個U距離相等且最近,每個U原子重復了兩次,因此在晶胞與U距離相等且最近的U原子數為8×3×
+1=4,因此一個晶胞中含有U、N原子個數均為4個,化學式為UN,由于N原子最外層有5個電子,N化合價為-3價,所以U元素的化合價為+3,根據圖示可知:在晶胞與U距離相等且最近的U在一個晶胞的面心上,通過一個U原子有8個晶胞,在一個晶胞中有3個U距離相等且最近,每個U原子重復了兩次,因此在晶胞與U距離相等且最近的U原子數為8×3×![]() =12;
=12;
②在一個晶胞中含有U原子數目為U:8×![]() +6×
+6×![]() =4,含有的N原子數目為8×1=8,一個晶胞中含有的U、N原子的總體積為V(U)+V(N)=(4×
=4,含有的N原子數目為8×1=8,一個晶胞中含有的U、N原子的總體積為V(U)+V(N)=(4×![]() +8×
+8×![]() )cm3;根據圖示可知晶胞參數為4個U原子的半徑的
)cm3;根據圖示可知晶胞參數為4個U原子的半徑的![]() 倍;
倍;![]() L=4r1cm,晶胞的體積V(晶胞)=
L=4r1cm,晶胞的體積V(晶胞)=![]() ,則該晶體中原子利用率為
,則該晶體中原子利用率為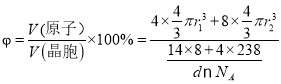 ×100%。
×100%。


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:
【題目】I.H2A在水中存在以下平衡:H2A![]() H+ +HA- ,HA-
H+ +HA- ,HA-![]() H++A2- 。
H++A2- 。
(1)NaHA溶液顯酸性,則溶液中離子濃度的大小順序為____________________。
(2)常溫時,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此時該混合溶液的下列關系中,一定正確的是_______________。
A.c(Na+ )>c(K+) B.c(H +)c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:CaA(s)![]() Ca2+ (aq)+A2- (aq),滴加少量Na2A固體,c(Ca2+ )_______________(填“增大”、“減小”或“不變”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固體,c(Ca2+ )_______________(填“增大”、“減小”或“不變”),原因是________________。
Ⅱ.含有Cr2O72-的廢水毒性較大,某工廠廢水中含4.00×10-3 mol/L的Cr2O72-。為使廢水能達標排放,作如下處理:![]()
(1)該廢水中加入FeSO4·7H2O和稀硫酸,發生反應的離子方程式為:_______________。
(2)欲使25 L該廢水中Cr2O7 轉化為Cr3+,理論上需要加入__________g FeSO4·7H2O。
(3)若處理后的廢水中殘留的c(Fe)=1×10-13mol/L,則殘留的 Cr3+ 的濃度為__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖兩種化合物的結構或性質描述正確的是
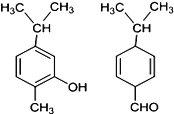
A. 兩種化合物均是芳香烴
B. 兩種化合物可用紅外光譜區分,但不能用核磁共振氫譜區分
C. 兩種化合物分子中共平面的碳原子數相同
D. 兩種化合物互為同分異構體,均能與溴水反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知制備膠體的反應原理為: FeCl3+3H2O![]() Fe(OH)3(膠體)+3HCl,現有甲、乙、丙三名同學分別進行制備Fe(OH)3膠體的實驗
Fe(OH)3(膠體)+3HCl,現有甲、乙、丙三名同學分別進行制備Fe(OH)3膠體的實驗
Ⅰ、甲同學直接加熱飽和FeCl3溶液;
Ⅱ、乙同學向25 mL沸水中逐滴加入FeCl3飽和溶液;煮沸至液體呈紅褐色,停止加熱
Ⅲ、丙同學和乙同學一樣,但是溶液出現紅褐色后忘記停止,繼續加熱較長時間。
試回答下列問題:
(1)判斷膠體制備是否成功,可利用膠體的__________________________,其中操作方法及現象是_____________________________________。
(2)Fe(OH)3膠體是不是電解質:_______________(填“是”或“不是”)。
(3)丁同學檢查實驗結果發現___________(填甲、乙或丙)的燒杯底部有沉淀。
(4)丁同學利用所制得的Fe(OH)3膠體進行下列實驗:
①取部分膠體將其裝入U形管內,用石墨作電極,接通直流電,通電一段時間后發現陰極附近的顏色逐漸變深,這表明Fe(OH)3膠體的膠粒帶___________電荷。
②取部分膠體向其中逐滴滴加硫酸溶液,開始產生紅褐色沉淀,這是因為_________;繼續滴加,沉淀減少最終消失,寫出化學反應方程式__________________。
③欲除去Fe(OH)3膠體中混有的NaCl溶液的操作名稱是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 1mol/LAlCl3溶液中,含![]() 數目小于
數目小于![]()
B. 25℃,![]() pH=1的稀硫酸中含有的
pH=1的稀硫酸中含有的![]() 數為
數為![]()
C. 標準狀況下,![]()
![]() 和
和![]() 混合氣體中含
混合氣體中含![]() 個原子
個原子
D. 由![]()
![]() 和少量
和少量![]() 形成的中性溶液中,CH3COO-數目為
形成的中性溶液中,CH3COO-數目為![]() 個
個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種短周期元素的原子序數依次增大。已知A、C、F位于同一周期,三種元素原子的最外層共有11個電子,且這三種元素的最高價氧化物的水化物之間兩兩皆能反應,均生成鹽和水,D元素原子的最外層電子數比次外層電子數少4個,E元素原子的次外層電子數比最外層電子數多3個。試回答:
(1)寫出下列元素的元素符號:
A_____,C_____,D_____,E__________
(2)用電子式表示B、F形成的化合物_____。
(3)A、C兩種元素最高價氧化物的水化物之間反應的化學方程式為_____, C、F兩種元素最高價氧化物的水化物之間反應的離子方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用兩支惰性電極插入50mLAgNO3溶液中,通電電解。當電解液的PH值從6.0變為3.0時(設電解時陰極沒有氫氣析出,且電解液在電解前后體積變化可以忽略),電極上析出銀的質量大約是:
A. 27mg B. 54mg C. 108mg D. 216mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在如圖所示的三個燒杯中均盛有足量的氯化銅溶液。請按要求回答下列問題:
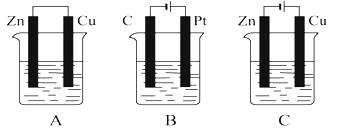
(1)![]() 、
、![]() 、
、![]() 三個裝置中不屬于電解池的是______。
三個裝置中不屬于電解池的是______。
(2)![]() 池中
池中![]() 是______極,
是______極,![]() 池中
池中![]() 移向______極(填“
移向______極(填“![]() ”或“
”或“![]() ”)。
”)。
(3)![]() 池中
池中![]() 電極上發生反應__________(填“氧化”或“還原”)
電極上發生反應__________(填“氧化”或“還原”)
(4)![]() 池中
池中![]() 電極上的電極反應為______,反應過程中
電極上的電極反應為______,反應過程中![]() ______(填“變大”“變小”或“不變”)
______(填“變大”“變小”或“不變”)
(5)![]() 池中總反應的化學方程式為______
池中總反應的化學方程式為______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究電化學原理與應用有非常重要的意義。
(1)鋅錳電池(俗稱干電池) 是一種一次電池,生活中應用廣泛。
①鋅錳電池負極上的電極反應式為:______________________________。
②與普通(酸性)鋅錳電池相比較,堿性鋅錳電池的優點是____________________(回答一條即可)。
(2)鉛蓄電池是最常見的二次電池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充電時陰極反應為:________________________________________。
②用鉛蓄電池為電源進行電解飽和食鹽水實驗(石墨棒為陽極,鐵為陰極,食鹽水500mL,溫度為常溫),當電路中有0.05mol電子轉移時,食鹽水的PH為______(假設溶液體積不變,產物無損耗)。
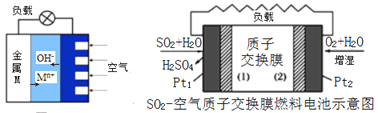
(3)如圖是金屬(M)-空氣電池的工作原理,我國首創的海洋電池以鋁板為負極,鉑網為正極,海水為電解質溶液,電池反應為:___________________________ 。二氧化硫—空氣質子交換膜燃料電池實現了制硫酸、發電、環保三位一體的結合,原理如圖所示。Pt2上的電極反應式為:_______________________________________ 。
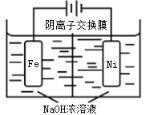
(4)高鐵酸鈉(Na2FeO4)易溶于水,是一種新型多功能水處理劑,可以用電解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如圖所示。裝置通電后,鐵電極附近生成紫紅色的FeO42,鎳電極有氣泡產生。電解一段時間后,c(OH)降低的區域在_____________(填“陰極室”或“陽極室”);陽極反應為:___________________________。
FeO42+3H2↑,工作原理如圖所示。裝置通電后,鐵電極附近生成紫紅色的FeO42,鎳電極有氣泡產生。電解一段時間后,c(OH)降低的區域在_____________(填“陰極室”或“陽極室”);陽極反應為:___________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com