
 硝酸銨鈣[5Ca(NO3)2•NH4NO3•10H2O]極易溶于水,是一種綠色復合肥料.
硝酸銨鈣[5Ca(NO3)2•NH4NO3•10H2O]極易溶于水,是一種綠色復合肥料.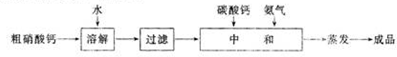
分析 (1)銨根離子水解顯酸性;
(2)粗硝酸鈣(含硝酸鈣、難溶物及硝酸)加水溶解,過濾得含硝酸鈣和硝酸的溶液,加入碳酸鈣與硝酸反應生成硝酸鈣、水和二氧化碳氣體,再通入氨氣中和硝酸生成硝酸銨,最終所得的溶液為硝酸鈣和硝酸銨的混合溶液,蒸發結晶得到硝酸銨鈣[5Ca(NO3)2•NH4NO3•10H2O]晶體,據此分析解答;
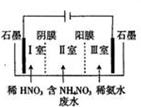
(3)①反硝化是利用某些細菌在酸性條件下將NO3-得到電子發生還原反應生成N2,據此書寫;
②根據膜電解法陽極上為氫氧根離子失電子發生的氧化反應;Ⅰ室消耗氫氧根離子使酸性增強,與向陽極移動的硝酸根結合成硝酸;
③電解時,Ⅲ室為陰極應為氫離子得電子發生還原反應,消耗氫離子使堿性增強,與向陰極移動的銨根離子反應生成氨氣,據此分析;
解答 解:(1)銨根離子水解顯酸性,則水解離子反應為NH4++H2O?NH3•H2O+H+,
故答案為:NH4++H2O?NH3•H2O+H+;
(2)粗硝酸鈣(含硝酸鈣、難溶物及硝酸)加水溶解,過濾得含硝酸鈣和硝酸的溶液,加入碳酸鈣與硝酸反應生成硝酸鈣、水和二氧化碳氣體,再通入氨氣中和硝酸生成硝酸銨,最終所得的溶液為硝酸鈣和硝酸銨的混合溶液,蒸發結晶得到硝酸銨鈣[5Ca(NO3)2•NH4NO3•10H2O]晶體,
①加入碳酸鈣與硝酸反應生成硝酸鈣、水和二氧化碳氣體,發生反應的離子方程式為CaCO3+2H+═Ca2++CO2↑+H2O,又最終要蒸發結晶得到硝酸銨鈣[5Ca(NO3)2•NH4NO3•10H2O]晶體,所以溶液中要保證硝酸鈣與硝酸銨之比為5:1,又NH3+HNO3═NH4NO3,所以通入氨氣前,應控制n[Ca(NO3)2]:n(HNO3)=5:1,故答案為:CaCO3+2H+═Ca2++CO2↑+H2O;5:1;
②因為氨氣和硝酸反應制取硝酸銨為放熱反應,所以低溫有利于反應向生成硝酸銨的方向進行,所以反應需要在-5℃進行,故答案為:氨氣和硝酸反應制取硝酸銨為放熱反應;
(3)①反硝化是利用某些細菌在酸性條件下將NO3-轉化為N2,即NO3-得到電子發生還原反應生成N2,反應式為2NO3-+10e-+12H+═6H2O+N2↑,故答案為:2NO3-+10e-+12H+═6H2O+N2↑;
②膜電解法陽極上為氫氧根離子失電子發生的氧化反應,反應式為4OH--4e-═2H2O+O2↑,則Ⅰ室陽極消耗氫氧根離子使酸性增強,與向陽極移動的硝酸根結合成硝酸,所以Ⅰ室可回收的產品為硝酸;故答案為:4OH--4e-═2H2O+O2↑;硝酸;
③電解時,Ⅲ室為陰極應為氫離子得電子發生還原反應,則消耗氫離子使堿性增強,與向陰極移動的銨根離子反應生成氨氣,所以Ⅲ室可回收到氨氣,故答案為:電解時,Ⅲ室氫離子得電子發生還原反應使堿性增強,與向陰極移動的銨根離子反應生成氨氣;
點評 本題主要考查了工業生產硝酸銨鈣的原理及廢水的處理,意在考查考生閱讀新信息,處理新情況的能力,電解裝置的分析及其電極反應式的書寫是易錯點,難度較大.


 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:選擇題
| A. | 第二種粒子是氧元素的另一種核素 | |
| B. | “四中子”的質量數為4,其質量比氫原子大 | |
| C. | “四中子”不顯電性 | |
| D. | 第二種粒子的化學式為O4,與O2互為同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入足量BaCl2溶液反應,過濾、洗滌、干燥、恒重,稱得固體質量為W1 g | |
| B. | 加入過量的W2 g Zn充分反應后,過濾、洗滌、干燥、恒重,稱得固體質量為W3 g | |
| C. | 加入過量的W4 g CaCO3反應停止后,過濾、洗滌、干燥、恒重,稱得固體質量為W5 g | |
| D. | 滴入適當指示劑,用已知濃度的NaOH溶液進行滴定,消耗NaOH溶液的體積為V mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
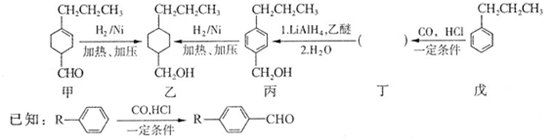
 和
和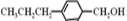 生成(寫結構簡式).
生成(寫結構簡式). .
. +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$ +HCl或
+HCl或 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.(有機化合物均用結構簡式表示)
+NaCl.(有機化合物均用結構簡式表示)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HA為強酸 | B. | 該混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 該混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 molCaC2晶體中含有的離子總數為3NA | |
| B. | 常溫常壓下,3g-CH3中含有的電子數為1.8NA | |
| C. | NA個HCl分子與22.4LH2和Cl2的混合氣體所含有的原子數均為2NA | |
| D. | 80 mL 12 mol/L的濃鹽酸與足量MnO2反應,生成的Cl2分子數目為0.48 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com