
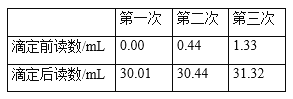
【題目】某學習小組欲測定市售橙汁飲料中維生素C的含量。每100克鮮榨橙汁中含有大約37.5毫克的維生素C。實驗室可用碘量法測定橙汁飲料中維生素C的含量,反應的方程式為C6H8O6+I2==C6H6O6+2HI(維生素C化學式為C6H8O6,相對分子質量為176),其實驗步驟及相關數據如下:
①標準溶液的稀釋:移取濃度為0.0080mol/L的碘標準溶液25.00mL于250mL容量瓶中,定容,搖勻備用。
②移取10.00mL飲料樣品(設密度為1.0g/cm3)于250 mL錐形瓶中,加入50mL蒸餾水,2mL指示劑。
③在滴定管中裝入稀釋后的標準溶液,滴定至終點,讀取并記錄相關數據。
④重復測定3次,數據記錄如下表。
回答下列問題:
(1)實驗中盛裝標準溶液應選擇______(填“酸式”或“堿式”)滴定管。
(2)步驟2中加入的指示劑是___________,判斷滴定達到終點的現象是__________。
(3)實驗中下列操作可能導致測定結果偏低的是_______(填標號)。
A.稀釋標準溶液定容時俯視刻度線
B.滴定結束時俯視讀
C.在錐形瓶中加入樣品后放置較長時間才開始滴定
D.滴定管尖嘴部分有氣泡,滴定后消失
(4)計算該飲料樣品中維生素C含量為________mg/100 g。該含量______(填“高于”或“低于”)鮮榨橙汁。
【答案】酸式 淀粉溶液 溶液變為藍色,且半分鐘不褪色 ABC 42.2 高于
【解析】
⑴單質碘易腐蝕橡皮管。
⑵用單質碘滴定,得出加入的指示劑。
⑶A. 稀釋標準溶液定容時俯視刻度線,溶液體積偏小,標液濃度偏大,所消耗標液體積減少,濃度偏低;B. 滴定結束時俯視讀數,溶液體積偏小,測定結果偏低;C. 在錐形瓶中加入樣品后放置較長時間才開始滴定,部分被被氧化,所消耗標液體積減少,測定結果偏低;D. 滴定管尖嘴部分有氣泡,滴定后消失,得到消耗標液體積偏大,測定結果偏高。
⑷得出三次數據的平均值和碘標準溶液濃度,根據方程式得到10mL飲料中C6H8O6的物質的量,再得100g飲料樣品中維生素C含量的質量。
⑴單質碘易腐蝕橡皮管,因此實驗中盛裝標準溶液應選擇酸式滴定管;故答案為:酸式。
⑵用單質碘滴定,因此步驟2中加入的指示劑是淀粉溶液,判斷滴定達到終點的現象是溶液變為藍色,且半分鐘不褪色;故答案為:溶液變為藍色,且半分鐘不褪色。
⑶A. 稀釋標準溶液定容時俯視刻度線,溶液體積偏小,標液濃度偏大,所消耗標液體積減少,濃度偏低,故A符合題意;
B. 滴定結束時俯視讀數,溶液體積偏小,測定結果偏低,故B符合題意;
C. 在錐形瓶中加入樣品后放置較長時間才開始滴定,部分被被氧化,所消耗標液體積減少,測定結果偏低,故C符合題意;
D. 滴定管尖嘴部分有氣泡,滴定后消失,得到消耗標液體積偏大,測定結果偏高,故D不符合題意。
綜上所述,答案為ABC。
⑷三次數據的平均值為30.00mL,移取濃度為0.0080 molL1的碘標準溶液25.00 mL于250 mL容量瓶中,定容,搖勻備用,碘標準溶液濃度為0.0008 molL1,根據C6H8O6+I2 = C6H6O6+2HI得到10mL飲料即10g中C6H8O6的物質的量n(C6H8O6)= 0.0008 molL1×0.03L = 2.4×105 mol,則100g飲料樣品中維生素C含量為2.4×105 mol ×10×176×103mg![]() mol1= 42.2mg,即該飲料樣品中維生素C含量為42.2mg/100g該含量高于鮮榨橙汁;故答案為:42.2;高于。
mol1= 42.2mg,即該飲料樣品中維生素C含量為42.2mg/100g該含量高于鮮榨橙汁;故答案為:42.2;高于。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】常溫下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及導電性變化如圖。
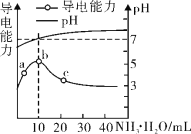
下列分析正確的是
A.HR為強酸
B.加入10 mL 氨水時,溶液中c(NH4+)>c(R-)
C.c點溶液存在c(NH4+)<c( R-)
D.b點的離子濃度大于a點的離子濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PVAc是一種具有熱塑性的樹脂,可合成重要的高分子材料![]() ,合成路線如下:
,合成路線如下:
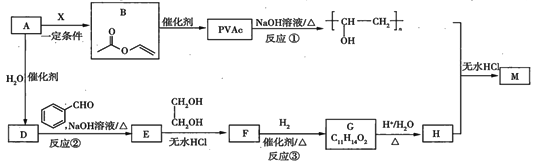
已知:
Ⅰ.![]() ;
;
Ⅱ.RCHO+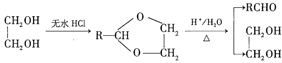
(1)標準狀況下,![]() 氣態烴
氣態烴![]() 的質量是5.2g,則
的質量是5.2g,則![]() 的結構簡式為___________。
的結構簡式為___________。
(2)已知![]() 為加成反應,則
為加成反應,則![]() 的結構簡式為_______;
的結構簡式為_______;![]() 中所含官能團的名稱是__________。
中所含官能團的名稱是__________。
(3)反應①的化學方程式為__________________。
(4)反應③的化學方程式為__________________。
(5)在![]() 的轉化過程中,乙二醇的作用是________________。
的轉化過程中,乙二醇的作用是________________。
(6)已知![]() 的鏈節中除苯環外,還含有六元環狀結構,則
的鏈節中除苯環外,還含有六元環狀結構,則![]() 的結構簡式為____________。
的結構簡式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在試管中進行下列實驗,現象與實驗操作不相匹配的是
實驗操作 | 實驗現象 | |
A | 向硫酸銅水溶液中逐滴加入氨水 | 先產生藍色沉淀,然后溶解,最后得到深藍色透明溶液 |
B | 向I2的CCl4溶液中加入濃KI溶液,振蕩 | 溶液紫紅色變淺 |
C | 向橙色的K2Cr2O7溶液中加入10滴濃硫酸,振蕩 | 溶液由橙色變為黃色 |
D | 向飽和硼酸溶液中加入Na2CO3溶液 | 無明顯現象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,利用合成氣(CO、H2、CO2)在催化劑的作用下合成甲醇,可能發生的反應如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反應③的ΔH3=________,化學平衡常數K3與K1、K2的代數關系是K3=_____。
(2)要使反應②的速率和轉化率都增大,需要改變的條件是___________。在5MPa下,要提高反應②的轉化率,可采取的措施有__________、_________(答兩條)。
(3)若反應①在恒容密閉容器中進行,下列可以判斷該反應達到平衡的是_______(填標號)。
A.v正(H2)=v逆(CH3OH) B.混合氣壓強不變
C.c(H2)與c(H2O)比值不變 D.混合氣密度不變
(4)在一定溫度和催化劑存在下,向1L密閉容器中充入1molCO2和3molH2發生反應①。當CO2的平衡轉化率為50%時,產物甲醇的體積分數為________,該溫度下,正反應的平衡常數K=__________。若向容器中再充入0.5molH2和0.5molH2O(g),其他條件不變時平衡_______移動(填“正向”“逆向”“不”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的有機產物,肯定是一種的是( )
A. 異戊二烯(![]() )與等物質的量的Br2發生加成反應
)與等物質的量的Br2發生加成反應
B. 2—氯丁烷(![]() )與NaOH溶液共熱發生反應
)與NaOH溶液共熱發生反應
C. 甲苯在一定條件下發生硝化生成一硝基甲苯的反應
D. 等物質的量的甲烷和氯氣的混和氣體長時間光照后的產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家從腐敗草中提取出一種能使血液不凝固的雙豆香素M,M的結構簡式如圖所示。下列說法正確的是( )
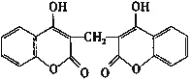
A.M能使溴水、酸性高錳酸鉀溶液褪色,其褪色原理相同
B.M分子中所有原子可能處于同一平面
C.M分子中苯環上的一氯代物有4種
D.M分子有3種含氧官能團
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼砂是含結晶水的四硼酸鈉,其陰離子Xm-(含B、O、H三種元素)的球棍模型如圖所示。下列說法正確的是( )

A.m=2
B.在Xm-中,硼原子軌道的雜化類型相同
C.1、2原子間和4、5原子間的化學鍵可能是配位鍵
D.Xm-中含離子鍵和配位鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列說法不正確的是( )
A.用來制造電線電纜的聚乙烯樹脂屬于熱塑性高分子材料
B.研發可降解高分子材料,可以減少“白色污染”
C.棉、麻、羊毛及合成纖維完全燃燒都只生成![]() 和
和![]()
D.硅橡膠![]() 可由
可由![]() 經水解、縮聚兩步反應制得
經水解、縮聚兩步反應制得
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com