
| A. | 7.1gCl2與足量的氫氧化鈉溶液反應轉移的電子數一定為0.2NA | |
| B. | 在常溫常壓下,11.2 升氯氣含有的分子數為0.5NA | |
| C. | 常溫常壓下,32 g O2和O3的混合氣體所含原子數為2NA | |
| D. | 1 molFe與足量的Cl2反應轉移的電子數為2NA |
分析 A、求出氯氣的物質的量,然后根據氯氣和堿的反應為歧化反應來分析;
B、常溫常壓下,氣體摩爾體積大于22.4L/mol;
C、氧氣和臭氧均由氧原子構成;
D、鐵與氯氣反應后變為+3價.
解答 解:A、7.1g氯氣的物質的量為0.1mol,而氯氣和堿的反應為歧化反應,故0.1mol氯氣轉移0.1mol電子即0.1NA個,故A錯誤;
B、常溫常壓下,氣體摩爾體積大于22.4L/mol,故11.2L氯氣的物質的量小于0.5mol,故含有的分子數小于0.5NA個,故B錯誤;
C、氧氣和臭氧均由氧原子構成,故32g氧氣和臭氧中含有的氧原子的物質的量為n=$\frac{32g}{16g/mol}$=2mol,故為2NA個,故C正確;
D、鐵與氯氣反應后變為+3價,故1mol鐵與氯氣反應后轉移3mol電子即3NA個,故D錯誤.
故選C.
點評 本題考查了阿伏伽德羅常數的有關計算,掌握物質的量的計算公式和物質結構是解題關鍵,難度不大.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 放電時,電池的負極反應為LiC6-e-═Li++C6 | |
| B. | 充電時,電池的正極反應為CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活潑氫的有機物可用作鋰離子電池的電解質 | |
| D. | 鋰離子電池的比能量(單位質量釋放的能量)低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
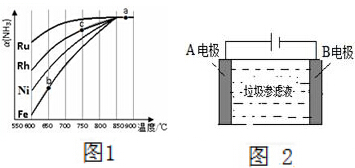 氨氣在生產、生活和科研中應用十分廣泛.
氨氣在生產、生活和科研中應用十分廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介質中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的電離方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2與H2O反應:Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉膠體加入電解質可發生聚沉現象 | |
| B. | 向Fe(OH)3膠體中加入少量H2SO4溶液,會生成紅褐色沉淀 | |
| C. | 可利用丁達爾效應區分膠體與溶液 | |
| D. | 膠體微粒具有較大的表面積,能吸附陽離子或陰離子,故在電場作用下會產生電泳現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
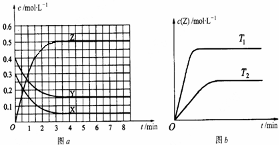
| A. | 該反應的正反應是放熱反應 | |
| B. | T0時,該反應的平衡常數為$\frac{1}{3}$ | |
| C. | 反應時各物質的反應速率關系為:2v (X)=2v (Y)=v (Z) | |
| D. | 圖a中反應達到平衡時,Y的轉化率為37.5% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制氯水顯酸性,向其中滴加少量紫色石蕊試液,充分振蕩后溶液變紅 | |
| B. | Na2O與Na2O2組成元素相同、陰陽離子個數比相同,但跟水反應的產物不同 | |
| C. | 只存在共價鍵的物質一定是共價化臺物、離子化合物中一定含有離子鍵 | |
| D. | 元素原子的最外層電子數越多,得電子能力越強,失電子能力越弱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com