
【題目】請按要求用合適的化學用語填空
(1)基態P原子的電子排布式:______________
(2)Fe3+ 外圍電子排布圖:_______________
(3)用電子式表示MgCl2的形成過程:_______
(4)用水解方程式表示明礬能凈水的原因:_______
【答案】1s22s22p63s23p3 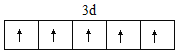
![]() Al3++3H2OAl(OH)3+3H+
Al3++3H2OAl(OH)3+3H+
【解析】
(1)P為15號元素;
(2)Fe為26號元素,形成離子時失去最外層電子;
(3)MgCl2為離子化合物,根據離子化合物的電子式表示方法寫出硫化鈉的形成過程;
(4)明礬溶于水產生鋁離子,鋁離子水解生成氫氧化鋁膠體可以凈水。
(1)P元素為15號元素,原子核外有15個電子,所以核外電子排布式為:1s22s22p63s23p3,故答案為:1s22s22p63s23p3;
(2)Fe3+的外圍電子排布為3d5,結合泡利原理、洪特規則畫出排布圖為 ,故答案為:
,故答案為: ;
;
(3)MgCl2為離子化合物,用電子式表示氯化鎂的形成過程為:![]() ;故答案為:
;故答案為:![]() ;
;
(4)明礬凈水是利用鋁離子水解生成氫氧化鋁膠體,Al3++3H2OAl(OH)3+3H+,生成的氫氧化鋁膠體具有吸附作用,可以凈水,故答案為:Al3++3H2OAl(OH)3+3H+。


科目:高中化學 來源: 題型:
【題目】主族元素W、X、Y、Z的原子序數依次增加,且均不大于20。W、X、Z族序數之和為10;Y的原子半徑在同周期主族元素中最小;W與Z形成的化合物常溫下可與飽和NaCl溶液反應,產生的氣體常用于切割和焊接金屬。下列說法錯誤的是

A. X的單質是人類將太陽能轉化為電能的常用材料
B. Y元素可以形成多種含氧酸
C. X元素在自然界中只有化合態沒有游離態
D. W與Z形成的化合物與飽和NaCl溶液的反應要選用如上圖裝置
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.已知25℃時,醋酸、碳酸、氫氰酸的電離平衡常數如下表:(單位省略)
醋酸 | 碳酸 | 氫氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)寫出碳酸的第一步電離方程式__________________________________。
(2)25℃時,等濃度的三種溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的順序為_____________________ (填序號)。
(3)25℃時,向NaCN溶液中通入少量CO2,反應的離子方程式為_______________。
(4)將濃度為0.02mol/L的HCN 與0.01mol/LNaOH 溶液等體積混合,測得混合溶液中c(Na+)>c(CN![]() ),下列關系正確的是_______。
),下列關系正確的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.請用有關電解質溶液的知識回答下列問題:
(1)某溫度下純水的c(H+)=4.0×10![]() mol/L,若溫度不變,滴入稀鹽酸,使c(H+)=2.0×10
mol/L,若溫度不變,滴入稀鹽酸,使c(H+)=2.0×10![]() mol/L,則此溶液中由水電離產生的c(H+)=_________。
mol/L,則此溶液中由水電離產生的c(H+)=_________。
(2)氫氧化銅懸濁液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常溫下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸銅溶液里c(Cu2+)=0.02 mol·L
。某硫酸銅溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,應調整溶液使之pH>________
,如要生成Cu(OH)2沉淀,應調整溶液使之pH>________
(3)向含有相同濃度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化學式)。在工業廢水處理過程中,依據沉淀轉化原理,可用FeS作為沉淀劑除去廢水中的Hg2+,寫出相應的離子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對煙道氣中![]() 進行回收再利用具有較高的社會價值和經濟價值。
進行回收再利用具有較高的社會價值和經濟價值。
I. ![]() 還原法
還原法

(1)一定條件下,由![]() 和
和![]() 反應生成
反應生成![]() 和
和![]() 的能量變化如圖所示,每生成
的能量變化如圖所示,每生成![]() ,該反應__________(填“放出”或“吸收”)的熱量為____________。
,該反應__________(填“放出”或“吸收”)的熱量為____________。
(2)在絕熱恒容的密閉容器中,進行反應:![]() ,該反應的平衡常數表達式為_______________________,對此反應下列說法正確的是_________。
,該反應的平衡常數表達式為_______________________,對此反應下列說法正確的是_________。
a.若混合氣體密度保持不變,則已達平衡狀態
b.從反應開始到平衡,容器內氣體的壓強保持不變
c.達平衡后若再充入一定量![]() ,平衡常數保持不變
,平衡常數保持不變
d.分離出![]() ,正、逆反應速率均保持不變
,正、逆反應速率均保持不變
(3)向![]() 恒溫恒容密閉容器中通入
恒溫恒容密閉容器中通入![]()
![]() 和
和![]()
![]() ,分別進行
,分別進行![]() 三組實驗。在不同條件下發生反應:
三組實驗。在不同條件下發生反應:![]() ,反應體系總壓強隨時間的變化曲線如圖所示,則三組實驗溫度的大小關系是
,反應體系總壓強隨時間的變化曲線如圖所示,則三組實驗溫度的大小關系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);實驗
”);實驗![]() 從反應開始至平衡時,反應速率
從反應開始至平衡時,反應速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常溫下,用![]() 溶液吸收
溶液吸收![]() 的過程中,溶液
的過程中,溶液![]() 隨吸收
隨吸收![]() 物質的量的變化曲線如圖所示。
物質的量的變化曲線如圖所示。

(4)常溫下,![]() 的二級電離平衡常數
的二級電離平衡常數![]() 的數值為_________________。
的數值為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為增強鋁的耐腐蝕性,現以鉛蓄電池為外電源(左池),以Al作陽極、Pb作陰極,電解稀硫酸(右池),使鋁表面的氧化膜增厚。反應原理如下:
電池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
電解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
關閉K,電解過程中,以下判斷正確的是

A. 兩池中H+均移向Pb電極
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb電極質量增加,右池Pb電極質量不變
D. 左池正極反應:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組在實驗室制取漂白粉,并探究氯氣與石灰乳反應條件和產物。
已知:①二氧化錳與濃鹽酸反應可制備氯氣,同時生成MnCl2
②氯氣和堿的反應為放熱反應。溫度較高時,氯氣和堿還能發生如下反應:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
該興趣小組設計了如圖實驗裝置,進行實驗。

請回答下列問題:
(1)①甲裝置用于制備氯氣,其發生反應的離子方程式為______________乙裝置的作用是 _____________
②實驗室用足量NaOH溶液吸收從濃鹽酸和MnO2反應體系中導出的氣體。當吸收溫度不同時,生成的產物可能是NaClO、NaClO3、NaCl中的兩種或三種。下列說法不正確的是___________。(填字母)
A.若產物為NaClO3、NaCl,則參加反應的氧化劑和還原劑的物質的量之比為1∶5
B.若產物為NaClO、NaCl,則吸收后的溶液中c(ClO-)=c(Cl-)
C.若產物為NaClO、NaClO3、NaCl,則NaOH與Cl2相互反應的物質的量之比為2∶1
(2)小組成員發現,產物中Ca(ClO)2的質量明顯小于理論值。他們討論后認為,其可能原因是部分氯氣未與石灰乳反應而逸出,以及溫度升高。為了探究反應條件對產物的影響,他們另取一定量的石灰乳,緩慢勻速地通入足量氯氣,得出了Ca(ClO)2、Ca(ClO3)2兩種物質的物質的量(n)與反應時間(t)的關系曲線,粗略表示為如圖(不考慮氯氣和水的反應)。則所取石灰乳中含有Ca(OH)2的物質的量為______________mol;

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多巴胺的一種合成路線如下圖所示

下列說法正確的是
A. 原料甲與苯酚互為同系物 B. 中間產物乙、丙和多巴胺都具有兩性
C. 多巴胺不可能存在氨基酸類的同分異構體 D. 1mol 甲最多可以和2 mol Br2發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅板上鐵鉚釘長期暴露在潮濕的空氣中,形成一層酸性水膜后鐵鉚釘會被腐蝕,示意圖如下。下列說法不正確的是

A. 腐蝕過程中銅極上始終只發生: 2H++2e-= H2↑
B. 若水膜中溶有食鹽將加快鐵鉚釘的腐蝕
C. 若在金屬表面涂一層油脂能防止鐵鉚釘被腐蝕
D. 若將該銅板與直流負極相連,則鐵銅均難被腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4KJ/mol,據此回答以下問題:
2NH3(g)△H=-92.4KJ/mol,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號)___________。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越__________。
(3)某溫度下,若把10 mol N2與30 mol H2置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________________(可用分數表示)。
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com