
分析 X、Y、Z、T、M、G6種元素分屬三個短周期,且原子序數依次增大;Y、Z可形成多種化合物,其中一種為紅棕色氣體,該氣體二氧化氮,根據原子序數Z大于Y可知,Z為O、Y為N;Z、M同主族,可形成ZM2、ZM3兩種分子,則M為S元素;G的原子序數大于S,且為主族元素,則G只能為Cl元素;X、T同主族,可形成離子化合物XT,則X是H元素,T的原子序數大于O,則T為Na元素,據此進行解答.
解答 解:X、Y、Z、T、M、G6種元素分屬三個短周期,且原子序數依次增大;Y、Z可形成多種化合物,其中一種為紅棕色氣體,該氣體二氧化氮,根據原子序數Z大于Y可知,Z為O、Y為N;Z、M同主族,可形成ZM2、ZM3兩種分子,則M為S元素;G的原子序數大于S,且為主族元素,則G只能為Cl元素;X、T同主族,可形成離子化合物XT,則X是H元素,T的原子序數大于O,則T為Na元素,
非金屬元素的非金屬性越強,其相應的最高價含氧酸的酸性越強,這幾種元素非金屬性最強的是Cl元素,所以其最高價含氧酸的酸性最強的是高氯酸HClO4;
非金屬性越弱,氣態氫化物還原性越強,還原性最強的氣態氫化物是硫化物 H2S;
XT為NaH,氫化鈉是鈉原子失去一個電子,氫原子得到這一個電子,均達到穩定結構的過程,其電子式為:Na+[:H]-;
Y為N元素,其氫化物為氨氣,氨氣的實驗室制法為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:HClO4;H2S;Na+[:H]-;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
點評 本題考查了位置、結構與性質關系的綜合應用,題目難度中等,能正確判斷元素是解本題的關鍵,注意元素化合物知識和元素周期律的綜合應用方法.


 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | I的原子半徑大于Br,HI比HBr的熱穩定性強 | |
| B. | P的非金屬性強于Si,H3PO4 比H2SiO3 的酸性強 | |
| C. | 增大反應物濃度可加快反應速率,因此用濃硫酸與鐵反應能增大生成H2的速率 | |
| D. | 用浸泡過高錳酸鉀溶液的硅藻土保存水果 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 每摩爾-CH3中含10NA個電子 | |
| B. | 每摩爾CnH2n+2中,碳原子與碳原子形成的共用電子對數目為nNA | |
| C. | 14g乙烯和丙烯的混合氣體中含有H原子數為2NA | |
| D. | 每摩爾苯中含有的碳氫單鍵的數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只含極性鍵的共價化合物 | |
| B. | 含非極性鍵的共價化合物 | |
| C. | 陰陽離子個數之比為1:1的離子化合物 | |
| D. | 可形成雙核離子或者四核離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
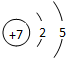 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
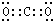 .
.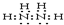
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應是吸熱反應 | |
| B. | SO2燃燒熱為196.64kJ•mol-1 | |
| C. | 在容器中充入1mol SO2和0.5mol O2充分反應,熱變化為98.32kJ | |
| D. | 當有NA個電子發生轉移時,熱變化為49.16kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com