
【題目】利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污
泥中Cr(Ⅲ)的處理工藝流程如下:

已知:①硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全時的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)實驗室用18.4 mol·L-1的濃硫酸配制480 mL 2 mol·L-1的硫酸,需量取濃硫酸___mL;配制時所用玻璃儀器除量筒、燒杯和玻璃棒外,還需____________________________。
(2)H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72-,寫出此反應的離子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈堿性,既可以除去某些雜質離子,同時又可以將Cr2O72-轉化為__________(填微粒的化學式)
(4)鈉離子交換樹脂的反應原理為:Mn+ + n NaR = MRn + n Na+,則利用鈉離子交換樹脂可除去濾液Ⅱ中的金屬陽離子有__________________。
(5)寫出上述流程中用SO2進行還原時發生反應的離子方程式______________________________。
(6)沉淀滴定法是測定粒子濃度的方法之一,為了測定某廢水中SCN-濃度,可用標準AgNO3溶液滴定待測液,已知:
銀鹽性質 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
顏色 | 白 | 黃 | 白 | 磚紅 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定時可選為滴定指示劑的是____(選填編號),滴定終點現象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
【答案】 54.3 500mL容量瓶、膠頭滴管 2Cr3++3H2O2+H2O=Cr2O72-+8H+ CrO42- Mg2+、Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH- B 當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變
【解析】試題分析:本題以制革工業污泥中Cr(III)處理的流程為載體,考查流程的分析,物質的量濃度溶液的配制,方程式的書寫,沉淀滴定實驗,溶度積的應用。
(1)根據“大而近”的原則,配制480mL溶液應選用500mL容量瓶。根據c(濃溶液)V(濃溶液)=c(稀溶液)V(稀溶液),18.4mol/LV(濃H2SO4)=2mol/L![]() 500mL,解得V(濃H2SO4)=54.3mL,需要量取濃硫酸54.3mL。配制的實驗步驟為:計算→量取→稀釋→冷卻→轉移→洗滌→初步振蕩→定容→搖勻→裝瓶貼標簽,配制時所用的玻璃儀器除量筒、燒杯和玻璃棒外,還需500mL容量瓶、膠頭滴管。
500mL,解得V(濃H2SO4)=54.3mL,需要量取濃硫酸54.3mL。配制的實驗步驟為:計算→量取→稀釋→冷卻→轉移→洗滌→初步振蕩→定容→搖勻→裝瓶貼標簽,配制時所用的玻璃儀器除量筒、燒杯和玻璃棒外,還需500mL容量瓶、膠頭滴管。
(2)H2O2將Cr3+氧化成Cr2O72-,H2O2被還原,反應可寫成H2O2+Cr3+→Cr2O72-,根據得失電子守恒配平為3H2O2+2Cr3+→Cr2O72-,結合原子守恒、電荷守恒以及濾液I呈酸性,H2O2將Cr3+氧化的離子方程式為3H2O2+2Cr3++H2O=Cr2O72-+8H+。
(3)根據各金屬陽離子形成沉淀的pH,加入NaOH溶液調pH=8,將Fe3+、Al3+完全轉化為Fe(OH)3、Al(OH)3沉淀而除去;同時將Cr2O72-轉化為CrO42-,反應可表示為Cr2O72-+2OH-=2CrO42-+H2O。
(4)加入NaOH溶液調pH=8除去了浸取液中的Fe3+和Al3+,根據浸取液中含有的金屬陽離子,利用鈉離子交換樹脂除去濾液II中的金屬陽離子為Mg2+、Ca2+。
(5)根據流程加入SO2將CrO42-還原為Cr(OH)(H2O)5SO4,SO2被氧化成SO42-,反應可寫成SO2+CrO42-→Cr(OH)(H2O)5SO4↓+SO42-,S元素的化合價由+4價升至+6價,Cr元素的化合價由+6價降至+3價,根據得失電子守恒配平為3SO2+2CrO42-→2Cr(OH)(H2O)5SO4↓+SO42-,結合原子守恒、電荷守恒和溶液呈堿性,寫出離子方程式為3SO2+2CrO42-+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-。
(6)A,若選擇NaCl作指示劑,AgCl、AgSCN的顏色都是白色,無法判斷滴定終點;B,若選用K2CrO4作指示劑,Ksp(Ag2CrO4)![]() Ksp(AgSCN),滴入AgNO3先與SCN-形成沉淀,當SCN-沉淀完全,滴入一滴AgNO3溶液與K2CrO4產生磚紅色沉淀,可判斷滴定終點;C,若選用KI作指示劑,Ksp(AgI)
Ksp(AgSCN),滴入AgNO3先與SCN-形成沉淀,當SCN-沉淀完全,滴入一滴AgNO3溶液與K2CrO4產生磚紅色沉淀,可判斷滴定終點;C,若選用KI作指示劑,Ksp(AgI)![]() Ksp(AgSCN),AgSCN與AgI類型相同,更易形成AgI沉淀,無法判斷滴定終點;D,若選用NaCN作指示劑,由于Ksp(AgCN)
Ksp(AgSCN),AgSCN與AgI類型相同,更易形成AgI沉淀,無法判斷滴定終點;D,若選用NaCN作指示劑,由于Ksp(AgCN)![]() Ksp(AgSCN),AgSCN與AgCN類型相同,更易形成AgCN沉淀,且AgCN、AgSCN的顏色都是白色,無法判斷滴定終點;選用K2CrO4作為指示劑,答案選B。終點實驗現象為:當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變。
Ksp(AgSCN),AgSCN與AgCN類型相同,更易形成AgCN沉淀,且AgCN、AgSCN的顏色都是白色,無法判斷滴定終點;選用K2CrO4作為指示劑,答案選B。終點實驗現象為:當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2,黃綠色易溶于水的氣體)是一種安全穩定、高效低毒的消毒劑。工業上通過惰性電極電解氯化銨和鹽酸的方法制備,其原理如圖所示:
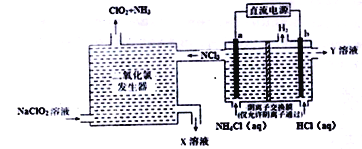
下列說法不正確的是
A. b電極接電源的負極,在b極區流出的Y溶液是稀鹽酸
B. 二氧化氯發生器中排出的X溶液中溶質主要為NaCl和NaOH
C. 電解過程中二氧化氯發生器中產生2.24L(標準狀況)NH3,則b極產生0.6gH2
D. 電解池a極的電極反應式為NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列各實驗裝置的敘述中,正確的是

A. 裝置①不可用于實驗室制取少量NH3或O2
B. 可用從a處加水的方法檢驗裝置②的氣密性
C. 實驗室可用裝置③收集HCl
D. 驗證溴乙烷發生消去反應生成烯烴的實驗可利用裝置④進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用KMnO4和濃鹽酸反應制取氯氣。
KMnO4+HCl(濃)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化學方程式,并用單線橋標出電子轉移的方向和數目__________。
(2)將上述配平的化學方程式改寫為離子方程式__________。
(3)濃鹽酸在反應中顯示出來的性質是________。
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若產生0.5 mol Cl2,則被氧化的HCl_____mol,轉移的電子的數目約為______。
(5)一定條件下,KMnO4還可以氧化其他還原性物質。___MnO4—+___C2O42—+_____=______Mn2++__CO2↑+____,完成上述離子方程式,此反應中,發生氧化反應的物質是__;若轉移1 mol電子,生成標準狀況下CO2______L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中僅含有一種溶質,若在該溶液中加入BaCl2溶液出現白色沉淀再加稀HNO3沉淀不消失,則該溶液不可能含有的溶質是( )
A.AgNO3
B.CuSO4
C.K2SO3
D.Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是天然有機高分子化合物,D是一種重要的化工原料,在相同條件下,G的蒸氣密度是E的2倍。它們之間的轉化關系如圖:

(1)有機物F中所含官能團名稱______________。
(2)以烷基鋁為催化劑,E能縮合生成G,該反應的化學方程式是_______________。
(3)下列說法不正確的是_____________。
A.上述轉化關系中有加成反應、取代反應、氧化反應
B.有機物B、C、D和E都能使酸性KMnO4溶液褪色
C.有機物C、F在濃H2SO4作用下可以制得G,反應中濃H2SO4是催化劑和吸水劑
D.某烴X的相對分子質量是D、H之和,則X能與溴水發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究不溶性鹽X(僅含5種元素)的組成和性質,設計并完成如下實驗(所加試劑均過量,氣體體積均在標準狀況下測定)。

請回答:
(1)X的組成元素為H、O和______(用元素符號表示),氣體C的電子式為_______。
(2)寫出反應①的離子方程式:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鋅可用于制造鋅鋇白、印染媒染劑等。用鋅白礦(主要成分為ZnO,還含有FeO、CuO、SiO2等雜質)制備ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“濾渣1”的主要成分是_______(填化學式)。“酸浸”過程中,為了提高鋅元素浸出速率,可采取的措施有:①適當提高酸的濃度,②_______(填一種)。
(2)“氧化”過程中,發生氧化還原反應的離子方程式是_______。
(3)“沉淀”過程中,加入ZnO產生Fe(OH)3沉淀的原因是_______。
(4)加入適量ZnO固體,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且測得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此時溶液中c(Cu2+)的取值范圍是_______mol/L。
(5)加入適量鋅粉的作用是_______。
(6)由濾液得到ZnSO47H2O的操作依次為_______、_______、過濾、洗滌、干燥。實驗室中過濾操作需要使用的玻璃儀器有燒杯、_______、_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 化學平衡正向發生移動時,平衡常數K值一定增大
B. HS-的電離方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水電離出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的離子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液與Na2CO3溶液混合發生反應:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com