
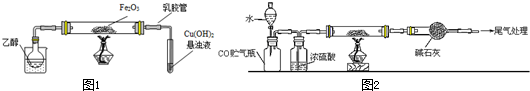
分析 (1)新制氫氧化銅濁液需要氫氧化鈉溶液過量,在堿性溶液中才會和醛基反應生成氧化亞銅紅色沉淀;
(2)依據圖1裝置分析可知,乙醇易揮發,可以對燒杯加熱或燒杯中加入熱水;阻止倒吸的操作是迅速拆下導氣管;
(3)依據反應現象可知,乙醇蒸氣在氧化鐵做催化劑作用下生成乙醛,試管內發生的是乙醛和氫氧化銅加熱反應生成紅色氧化亞銅沉淀;
(4)依據鐵離子的實驗檢驗方法分析,鐵離子加入硫氰酸鉀溶液會變紅色;乙醇和氧化鐵反應過程中可能會生成鐵或四氧化三鐵,能被磁鐵吸引;
(5)實驗過程依據反應原理和實驗目的分析實驗步驟為,組裝裝置,檢驗裝置氣密性,加入試劑,加入水吧一氧化碳趕入后續裝置,點燃酒精燈加熱玻璃管,反應結束后停止加熱,關閉分液漏斗活塞,玻璃管稱量剩余固體,依據質量變化計算鐵元素和氧元素物質的量之比;
(6)依據實驗結果得到,堿石灰增重mg,即二氧化碳的質量為mg,則鐵的氧化物中減少的質量為氧元素的質量為$\frac{16}{44}$mg=$\frac{4}{11}$mg,鐵的質量為(a-$\frac{4}{11}$m)g,依據元素物質的量計算得到比值.
解答 解:(1)新制氫氧化銅濁液需要氫氧化鈉溶液過量,在堿性溶液中才會和醛基反應生成氧化亞銅紅色沉淀,制備過程為在過量NaOH溶液中滴加數滴CuSO4溶液,
故答案為:在過量NaOH溶液中滴加數滴CuSO4溶液;
(2)依據圖1裝置分析可知,乙醇易揮發,可以對燒杯加熱或燒杯中加入熱水;阻止倒吸的操作是迅速拆下導氣管,
故答案為:在燒杯中加入熱水(對燒杯加熱);c;
(3)依據反應現象可知,乙醇蒸氣在氧化鐵做催化劑作用下生成乙醛,試管內發生的是乙醛和氫氧化銅加熱反應生成紅色氧化亞銅沉淀,反應的化學方程式為:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$Cu2O↓+CH3COOH+2H2O;
故答案為:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$Cu2O↓+CH3COOH+2H2O;
(4)依據鐵離子的實驗檢驗方法分析,鐵離子加入硫氰酸鉀溶液會變紅色,取少量溶液加入KSCN溶液,變紅色,則有Fe3+;氧化鐵做催化劑參與反應過程,乙醇和氧化鐵反應過程中可能會生成鐵或四氧化三鐵,能被磁鐵吸引;
故答案為:取少量溶液加入KSCN溶液,變紅色,則有Fe3+;b;
(5)實驗過程依據反應原理和實驗目的分析實驗步驟為,組裝裝置,檢驗裝置氣密性,加入試劑,加入水把一氧化碳趕入后續裝置,點燃酒精燈加熱玻璃管,反應結束后停止加熱,關閉分液漏斗活塞,玻璃管稱量剩余固體,依據質量變化計算鐵元素和氧元素物質的量之比,所以選c,
故答案為:c;
(6)依據實驗結果得到,堿石灰增重mg,即二氧化碳的質量為mg,則鐵的氧化物中減少的質量為氧元素的質量為$\frac{16}{44}$mg=$\frac{4}{11}$mg,鐵的質量為(a-$\frac{4}{11}$m)g,依據元素物質的量計算得到比值,n(Fe):n(O)=(a-$\frac{4}{11}$m):$\frac{4}{11}$m=$\frac{11a-4m}{4m}$,
故答案為:$\frac{11a-4m}{4m}$.
點評 本題考查了物質性質的實驗探究和物質組成的分析判斷,實驗操作步驟的設計和完善,實驗過程中的反應實質分析判斷,現象的理解和應用是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 金屬冶煉的本質是將化合態金屬還原為游離態,冶煉方法由金屬的活潑性決定 | |
| B. | Cu的濕法冶煉是將金屬鈉投入到CuSO4溶液中置換出銅 | |
| C. | 煉鐵時加入石灰石的目的是除去過量的碳 | |
| D. | 由于Al的活潑性強,故工業上采用電解熔融AlCl3的方法生產Al |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 晶體硅的導電性介于金屬和絕緣體之間,是良好的半導體 | |
| B. | 加熱到一定溫度時,硅能與氯氣、氧氣等非金屬反應 | |
| C. | 利用二氧化硅與C反應能制得粗硅 | |
| D. | 二氧化硅性質較穩定,常溫下不與任何物質反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 天津8.12爆炸事件中,港口保存有NaCN等劇毒物品.
天津8.12爆炸事件中,港口保存有NaCN等劇毒物品.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
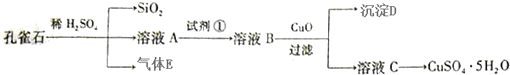
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
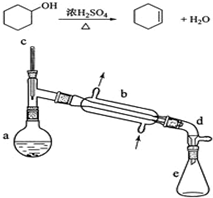 醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:| 相對分子質量 | 密度(g/cm3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.8102 | 83 | 難溶于水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com