
【題目】碳元素不僅能形成豐富多彩的有機化合物,而且還能形成多種無機化合物,同時自身可以形成多種單質,碳及其化合物的用途廣泛。
(1)C60分子中每個原子接2個單鍵和1個雙鍵,它與F2發生加成反應,其加成產物為_____;C60的晶體中,每個C60晶胞的質量為_______。(用含NA的式子表示)
(2)干冰和冰是兩種常見的分子晶體,下列關于兩種晶體的比較中正確的是_______。
a.晶體的密度:干冰>冰 b.晶體的熔點:干冰>冰
c.晶體中的空間利用率:干冰>冰 d.晶體中分子間相互作用力類型相同
(3)金剛石和石墨是碳元素形成的兩種常見單質,下列關于這兩種單質的敘述中正確的有____。
a.金剛石中碳原子的雜化類型為sp3雜化,石墨中碳原子的雜化類型為sp2雜化;
b.晶體中共價鍵的鍵長:金剛石中C—C<石墨中C—C;
c.晶休的熔點:金剛石>石墨
d.晶體中共價鍵的鍵角:金剛石>石墨
e.金剛石晶體中只存在共價鍵,石墨晶體中則存在共價鍵、金屬鍵和范德華力
f.金剛石和石墨的熔點都很高,所以金剛石和石墨都是原子晶體
(4)金剛石晶胞結構如圖,立方BN結構與金剛石相似,在BN晶體中,B原子周圍最近的N原子所構成的立體圖形為_______,B原子與N原子之間共價鍵與配價鍵的數目比為_____,一個晶胞中N 原子數目為_______。

(5)炭與孔雀石共熱可以得到金屬銅,基態銅原子的電子排布式為_______,銅采用_____堆積,則銅的晶體中Cu 原子的配位數為________。已知銅單質的晶體密度為pg/cm3,Cu的相對原子質量為M,阿伏伽德羅常數NA,則Cu的半徑為________。
【答案】 C60F60 ![]() ac ae 正四面體 3:1 4 [Ar]3d104s1 面心立方最密堆積 12
ac ae 正四面體 3:1 4 [Ar]3d104s1 面心立方最密堆積 12 ![]() cm
cm
【解析】(1)C60分子含有30個共價鍵,發生加成反應時一個C60分子中含有的碳碳雙鍵個數和氟氣分子個數相同,1molC60分子中30mol碳碳雙鍵,所以需要30mol氟氣,所以其加成產物的化學式為:C60F60;C60晶體為面心立方排布,所以每個C60晶胞有4個C60分子 (面心3個,頂點1個),所以一個C60晶胞=4×60/NA×12=2880/NAg;(2)a、水分子間存在氫鍵,且氫鍵有方向性,導致水分子形成冰時存在較大的空隙,密度比水小,干冰分子之間只存在范德華力,形成的分子晶體是密堆積,密度比水大,a正確;b、冰融化時氫鍵被破,干冰分子之間只存在范德華力,融化時破壞范德華力,氫鍵比范德華力強,故晶體的熔點冰>干冰,b錯誤;c、水分子間存在氫鍵,且氫鍵有方向性,導致水分子形成冰時存在較大的空隙,干冰分子之間只存在范德華力,形成的分子晶體是密堆積,晶體中的空間利用率:干冰>冰,c正確;d、干冰分子之間存在范德華力,水分子間存在氫鍵,晶體中分子間相互作用力類型不相同,d錯誤,答案選ac;(3)a、金剛石中碳原子與四個碳原子形成4個共價單鍵,構成正四面體,碳原子的雜化類型為sp3雜化;石墨中的碳原子與相鄰的三個碳原子以σ鍵結合,形成平面正六邊形結構,碳原子的雜化類型為sp2雜化,a正確;b、sp2雜化中,s軌道的成分比sp3雜化更多,而且石墨的碳原子還有大π鍵所以形成的共價鍵更短,更牢固,即石墨的層內共價鍵鍵長比金剛石的鍵長短,b錯誤;c、石墨的層內共價鍵鍵長比金剛石的鍵長短,作用力更大,破壞化學鍵需要更大能量,所以晶體的熔點金剛石<石墨,c錯誤;d、金剛石中碳原子與四個碳原子形成4個共價單鍵,構成正四面體,鍵角為109°28′,石墨中的碳原子用sp2雜化軌道與相鄰的三個碳原子以σ鍵結合,形成正六角形的平面層狀結構,鍵角為120°,d錯誤;e、金剛石中碳原子與四個碳原子形成4個共價單鍵,構成正四面體,石墨中的碳原子用sp2雜化軌道與相鄰的三個碳原子以σ鍵結合,形成正六角形的平面層狀結構,而每個碳原子還有一個2p軌道,其中有一個2p電子.這些p軌道又都互相平行,并垂直于碳原子sp2雜化軌道構成的平面,形成了大π鍵.因而這些π電子可以在整個碳原子平面上活動,類似金屬鍵的性質,石墨為層狀結構,層與層之間通過范德華力連接,說明晶體中含有共價鍵、金屬鍵、范德華力,e正確;f、金剛石是原子晶體,石墨為層狀結構,層與層之間通過范德華力連接,石墨為混合型晶體,不屬于原子晶體,f錯誤;答案選ae;(4)由金剛石的晶胞結構可知,晶胞內部有4個C原子,面心上有6個C原子,頂點有8個C原子,在BN晶體中,每個B原子和4個N原子形成共價鍵,所以B原子周圍最近的N原子所構成的立體圖形為正四面體;B原子的配位數是4,B原子與N原子之間共價鍵的數目是12,所以B原子與N原子之間共價鍵的數目與配位鍵的數目比為 3:1,一個晶胞中N原子數目為 4;(5)Cu的晶胞屬于面心立方晶胞,其配位數=3×8×1/2=12,銅是29號元素,核外電子排布式為[Ar]3d104s1;金屬銅采用面心立方最密堆積,晶胞內Cu原子數目為8×1/8+6×1/2=4,令銅原子的半徑為rcm,則晶胞的棱長為![]() ,所以
,所以![]() ,解得
,解得![]() cm。
cm。


科目:高中化學 來源: 題型:
【題目】下圖甲是利用一種微生物將廢水中尿素[CO(NH2)2]的化學能直接轉化為電能,并生成環境友好物質的裝置,同時利用此裝置在乙中的鐵上鍍銅。卞列說法中不正確的是
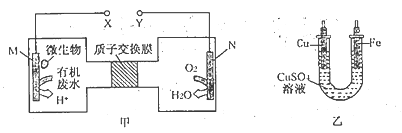
A. 銅電極應與Y電極相連接
B. H+通過質子交換膜由左向右移動
C. 當N電極消耗0. 25 mol氣體時,則鐵電極增重 16 g
D. M電極的反應式為:CO(NH2)2+ H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據最近報道,中國生產的首艘國產航母“山東”號已經下水。為保護航母、延長服役壽命可采用兩種電化學方法。方法1:艦體鑲嵌一些金屬塊;方法2:航母艦體與電源相連。下列有關說法正確的是( )
A. 方法1叫外加電流的陰極保護法
B. 方法2叫犧牲陽極的陰極保護法
C. 方法1中金屬塊可能是鋅、錫和銅
D. 方法2中艦體連接電源的負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 淀粉和纖維素水解的最終產物都是葡萄糖
B. 氯乙烯和溴乙烷均能發生加成反應
C. 天然油脂的主要成分是高級脂肪酸
D. CH≡CH和CH2=CHCH=CH2互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以重要的化工原料A(C2H2)合成有機物E和 的路線如圖所示,部分反應條件及產物略去。其中D在一定條件下可被氧化成酮。
的路線如圖所示,部分反應條件及產物略去。其中D在一定條件下可被氧化成酮。

回答下列問題:
(1)B的系統命名是______________;已知C是順式產物 ,則C的結構簡式為_____________________________。
(2)寫出⑤的化學方程式:________________________________,反應類型是________________。、
(3)反應⑧產物與新制Cu(OH)2的化學方程式:______________________________。
(4)符合下列條件肉桂酸( )的同分異構體有多種,①分子中含有苯環和碳碳雙鍵,②能夠發生銀鏡反應,③遇FeCl3溶液顯紫色,寫出其中核磁共振氫譜圖中有六組峰,且峰面積之比為1∶1∶1∶1∶2∶2的結構簡式_________________。
)的同分異構體有多種,①分子中含有苯環和碳碳雙鍵,②能夠發生銀鏡反應,③遇FeCl3溶液顯紫色,寫出其中核磁共振氫譜圖中有六組峰,且峰面積之比為1∶1∶1∶1∶2∶2的結構簡式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列四種有機化合物的結構簡式如下所示,均含有多個官能團,下列有關說法中正確的是( )

A. ①屬于酚類,可與NaHCO3溶液反應產生CO2
B. ②屬于酚類,能使FeCl3溶液顯紫色
C. 1 mol ③最多能與3 mol Br2發生反應
D. ④屬于醇類,可以發生消去反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去SO2中含有的少量HCl 氣體,可使氣體通過( )
A. 飽和Na2SO3溶液 B. 飽和NaHSO3溶液 C. 濃H2SO4 D. NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,發生反應:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器溫度不變,10min時改變一種條件,整個過程中PCl5、PCl3、Cl2的物質的量隨時間的變化如圖所示。下列說法正確的是

A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min時改變的條件是分離出一定量的PCl5
C. 起始時向該容器中充入2.0mol PCl3和2.0molCl2,保持溫度為T,反應達平衡時放出的熱量大于1.6akJ
D. 溫度為T,起始時向該容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反應達到平衡前,v(正)>v(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中c(Cl-)與100 mL lmol/LAlCl3溶液中c(Cl-)相等的是
A. 300mLlmol/L的NaCl溶液 B. 150mL2mol/L酌NH4Cl溶液
C. 200mL l.5 mol/L的KCl溶液 D. 75mLlmol/L的FeCl3溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com