
| A. | 1.6g由氧氣和臭氧組成的混合物中含有氧原子的數目為0.2NA | |
| B. | 在反應KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3molCl2轉移的電子數為6NA | |
| C. | 含4molSi-O鍵的二氧化硅晶體中,氧原子數為2NA | |
| D. | 某密閉容器中盛有0.2molSO2和0.1molO2,在一定條件下充分反應,生成SO2的分子數為0.2NA |
分析 A.氧氣和臭氧都只含有O原子,根據n=$\frac{m}{M}$計算出混合物中含有O的物質的量;
B.反應KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O中,只有Cl元素化合價發生變化,Cl元素化合價分別由+5價、-1價變為0價,當有3mol Cl2生成時,轉移5mol電子;
C.1mol二氧化硅中含有4mol硅氧鍵,含有2mol氧原子;
D.該反應為可逆反應,反應物不可能完全轉化成生成物.
解答 解:A.1.6g由氧氣和臭氧組成的混合物中含有1.6gO原子,含有氧原子的物質的量為:$\frac{1.6g}{16g/mol}$=0.1mol,含有氧原子的數目為0.1NA,故A錯誤;
B.該反應中,氯酸鉀中氯元素的化合價由+5價變為0價,所以氯酸鉀是氧化劑,HCl中Cl元素化合價由-1價升高到0價被氧化,化合價降低值=化合價升高值=轉移電子數=5,電子轉移方向和數目為: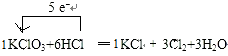 ,當有3mol Cl2生成時,轉移5mol電子,每生成3molCl2轉移的電子數為5NA,故B錯誤;
,當有3mol Cl2生成時,轉移5mol電子,每生成3molCl2轉移的電子數為5NA,故B錯誤;
C.含4mol Si-O鍵的二氧化硅的物質的量為1mol,1mol二氧化硅中含有2mol氧原子,氧原子數為2NA,故C正確;
D.某密閉容器中盛有0.2molSO2和0.1molO2,在一定條件下充分反應,由于該反應為可逆反應,則生成SO3的物質的量小于0.2mol,生成三氧化硫的分子數小于0.2NA,故D錯誤;
故選C.
點評 本題考查阿伏加德羅常數的計算與判斷,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,試題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:解答題
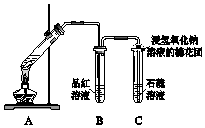 制備二氧化硫并研究其性質,如圖所示.
制備二氧化硫并研究其性質,如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
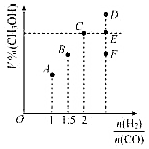 在工業上常用CO和H2合成甲醇,反應方程式為:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.
在工業上常用CO和H2合成甲醇,反應方程式為:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
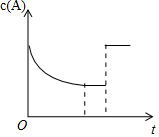 一定溫度下,將一定量的A、B氣體充入密閉容器,發生反應:A(g)+B(g)?xC(g)+3D(?),反應平衡后,改變影響平衡的一個條件,物質A的濃度變化如圖所示.下列有關說法正確的是( )
一定溫度下,將一定量的A、B氣體充入密閉容器,發生反應:A(g)+B(g)?xC(g)+3D(?),反應平衡后,改變影響平衡的一個條件,物質A的濃度變化如圖所示.下列有關說法正確的是( )| A. | x=2,C為氣態,D可能為氣態也可能為非氣態 | |
| B. | 改變的條件可能是使用了催化劑 | |
| C. | 其他條件不變,若向容器中再加入少量C,平衡逆向移動但平衡常數不變 | |
| D. | 該反應的化學平衡常數K=$\frac{{c}^{2}(C)}{[c(A)•c(B)]}$,且溫度升高,K值增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 “大象牙膏”的實驗操作是向30%的過氧化氫溶液中加入少量二氧化錳和表面活性劑,現象如圖.
“大象牙膏”的實驗操作是向30%的過氧化氫溶液中加入少量二氧化錳和表面活性劑,現象如圖.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com